强化监管 | 医疗器械生产企业重要时间节点相关工作提示清单!
2024-08-05

《深化医药卫生体制改革2024年重点工作任务》中提出:统筹推进其他重点改革,推进数字化赋能医改,全面实施第三类医疗器械(含体外诊断试剂)唯一标识。
为有序推进医疗器械唯一标识实施,进一步提升医疗器械全生命周期监管和企业质量管理效能,根据《年度质量管理体系自查报告》、《质量安全关键岗位人员职责权限》、《医疗器械质量管理体系用于法规的要求》(GB/T42061-2022)施行、《第三批医疗器械唯一标识实施》等方面的工作事项,列举了相关事项的具体要求、时间节点等内容,以帮助企业更好理清工作方向,做好工作计划。
***
## 《年度质量管理体系自查报告》
年度医疗器械质量管理体系自查报告的填报内容为当年度1月1日至12月31日统计数据,应于次年3月31日之前向药品监管部门提交。
填报内容至少包括:
(一)生产活动基本情况:包括注册人、备案人、受托生产企业基本信息,注册人、备案人名称、住所地址、生产地址、生产许可(备案)证号等;医疗器械产品注册证号或备案号以及生产情况(包括委托和受托生产等);获批创新产品、优先审批产品及附条件审批产品情况。
(二)委托与受托生产基本情况:对已获批上市医疗器械产品的委托生产情况、受托生产情况,包括委托生产产品基本信息、委托与受托生产双方基本信息、委托生产质量协议及对所委托生产产品的质量管理等。
(三)年度重要变更情况:产品设计变更情况、生产、检验区域及生产、检验设备变化情况、产品生产工序变化情况和重要供应商变化情况等。
(四)年度质量管理体系运行情况:组织机构及人员培训情况、生产管理和质量控制情况、采购管理情况、顾客反馈情况、不合格品控制、**追溯系统建立情况(UDI实施情况)**、内部审核和管理评审情况、不良事件监测、再评价工作情况等。
(五)其他事项:年度接受监管或认证检查情况、各级集中带量采购中选医疗器械情况、企业接受各级药品监管部门处罚的情况等。
***
## 《质量安全关键岗位人员职责权限》
根据《企业落实医疗器械质量安全主体责任监督管理规定》要求,生产企业质量安全关键岗位人员一般包括企业法定代表人和主要负责人(以下简称“企业负责人”)、管理者代表、质量管理部门负责人。其中企业负责人为最高管理者,管理者代表为高层管理人员,质量管理部门负责人一般为中层管理人员。
生产企业可以根据实际需要,在明确前款各岗位职责的前提下,增设质量副总经理、质量总监等岗位。
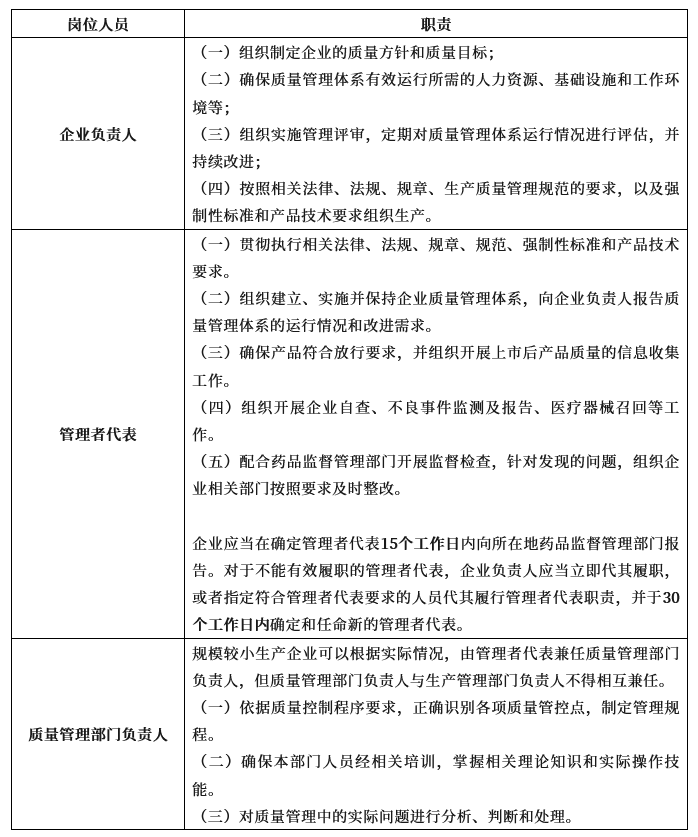
***
## 《医疗器械质量管理体系用于法规的要求》(GB/T42061-2022)
制造商、授权代表、进口商和经销商以下统称“组织”。

***
## 《第三批医疗器械唯一标识实施》
对列入第三批实施产品目录的医疗器械,注册人应当按照时限要求有序开展以下工作:
(一)唯一标识赋码
2024年6月1日起生产的医疗器械应当具有医疗器械唯一标识;此前已生产的第三批实施唯一标识的产品可不具有唯一标识。生产日期以医疗器械标签为准。
(二)唯一标识注册系统提交
2024年6月1日起申请注册的,注册申请人应当在注册管理系统中提交其产品最小销售单元的产品标识;2024年6月1日前已受理或者获准注册的,注册人应当在产品延续注册或者变更注册时,在注册管理系统中提交其产品最小销售单元的产品标识。
产品标识不属于注册审查事项,产品标识的单独变化不属于注册变更范畴。
(三)唯一标识数据库提交
2024年6月1日起生产的医疗器械,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库,确保数据真实、准确、完整、可追溯。
对于已在国家医保局医保医用耗材分类与代码数据库中维护信息的医疗器械,要在唯一标识数据库中补充完善医保医用耗材分类与代码字段,同时在医保医用耗材分类与代码数据库维护中完善医疗器械唯一标识相关信息,并确认与医疗器械唯一标识数据库数据的一致性。
当医疗器械最小销售单元产品标识相关数据发生变化时,注册人应当在产品上市销售前,在医疗器械唯一标识数据库中进行变更,实现数据更新。医疗器械最小销售单元产品标识变化时,应当按照新增产品标识在医疗器械唯一标识数据库上传数据。
自2024年6月1日起,UDI实施目录内的医疗器械产品都需要执行医疗器械唯一标识。同时,新注册的医疗器械产品(不区分类别)均需要在注册时提交UDI-DI。
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


