UDI科普|一文了解UDI体系流程脉络!
2021-08-09

医疗器械事关人民生命健康。那么与医疗器械息息相关的唯一标识(UDI)你又有几分了解呢?
UDI属于随时代发展的新兴事物,在全球范围来说目前仍处于持续发展当中。为了更好的帮助大家了解UDI,近期,UDI公共平台针对大家都比较关心的重点问题进行了整理与解答,从概念明晰、意义理解、建设目标、实施流程、后续应用等方面帮助大家建立清晰的UDI体系脉络。
**01、UDI是什么?**
医疗器械唯一标识(Unique Device Identifier,UDI)是医疗器械唯一性识别码,是医疗器械的“身份证”,是准确采集医疗器械全生命周期数据的基础,是解决医疗器械全球监管问题的通用语言、国际语言和专业语言。
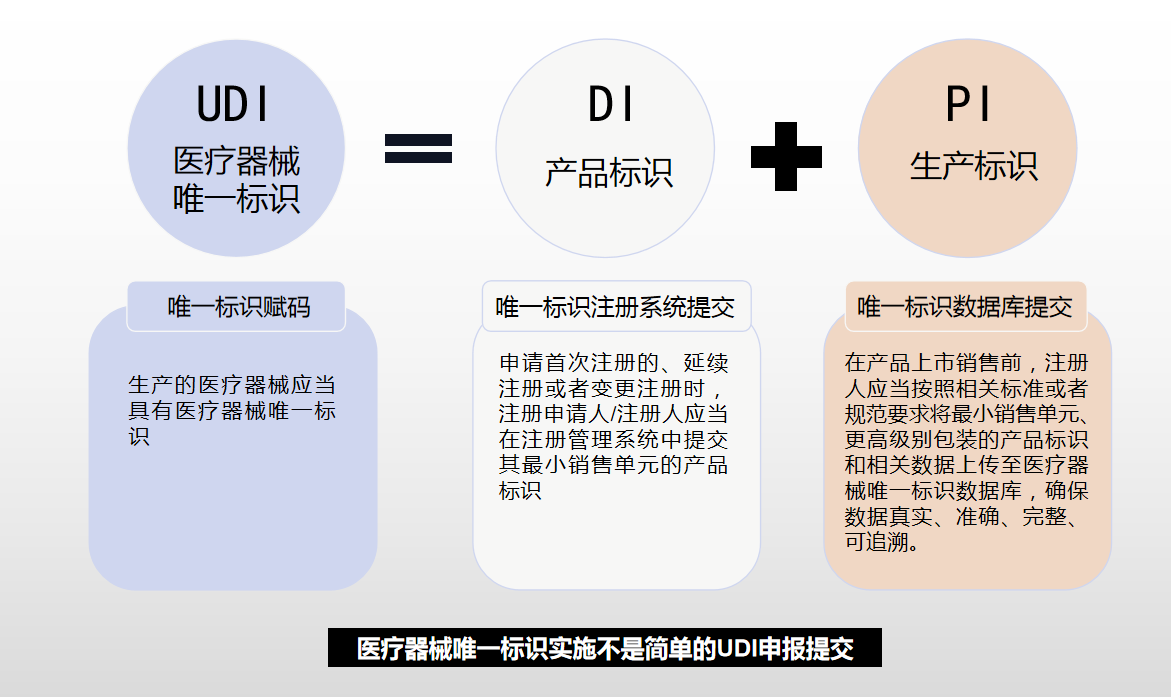
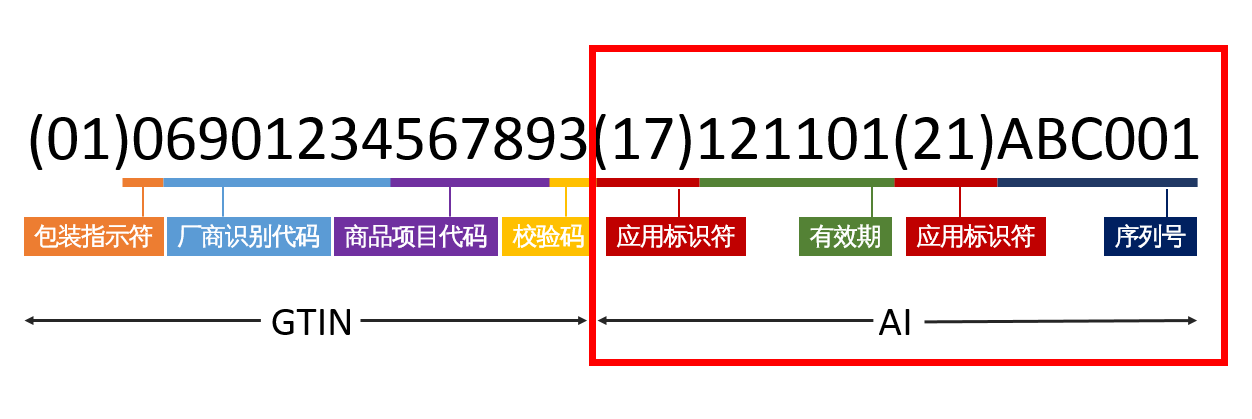
医疗器械唯一标识由产品标识(DI)和生产标识(PI)组成。产品标识是识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是从数据库获取医疗器械相关信息的“关键字”,是唯一标识的必须部分。生产标识包括与生产过程相关的信息,包括产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用,满足医疗器械流通和使用环节精细化识别和记录的需求。
**\**
**\**

**02、实施UDI有什么意义?**
####
医疗器械唯一标识(UDI)是实现全链条医疗器械通查通识,是加强全生命周期管理,提升监管效能的重要手段。
实施UDI是深入健康中国战略和深化医药卫生体制改革的决策部署之一,也是落实药品安全“四个最严”的要求之一。
建立医疗器械唯一标识系统有利于实现监管数据的整合和共享,创新监管模式,提升监管效能,加强医疗器械全生命周期管理,净化市场、优化营商环境,实现政府监管与社会治理相结合,形成社会共治的局面,助力产业转型升级和健康发展,提升医疗器械监管效能和卫生健康管理效率,为公众提供更加安全高效的医疗服务,切实保障公众用械安全,为推动形成医疗器械监管治理新格局奠定基础。
**03、国内UDI有哪些重要政策文件和标准?**
《国家药监局综合司 国家卫生健康委办公厅关于印发医疗器械唯一标识系统试点工作方案的通知》药监综械注〔2019〕56号
《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年 第106号)
《国家药监局 国家卫生健康委 国家医保局关于做好第二批实施医疗器械唯一标识工作的公告》(2021年第114号 )
[《国家药监局 国家卫生健康委 国家医保局关于做好第三批实施医疗器械唯一标识工作的公告》(2023年第22号)](https://udi.idcode.net/article/413)
《医疗器械唯一标识系统规则》
《YY/T1630-2018 医疗器械唯一标识基本要求》
《YY/T1681-2019 医疗器械唯一标识系统基础术语》
《YY/T1752-2020 医疗器械唯一标识数据库基本数据集》
《YY/T1753-2020 医疗器械唯一标识数据库填报指南》
《YY/T 1879-2022 医疗器械唯一标识的创建和赋予》
**04、UDI由谁来实施?**
根据《医疗器械唯一标识系统试点工作方案》要求,UDI由医疗器械注册人进行实施。医疗器械注册人要切实落实主体责任,,鼓励基于唯一标识建立健全追溯体系,做好产品召回、追踪追溯等有关工作。
按照唯一标识系统规则和标准,医疗器械注册人对其产品创建和赋予唯一标识,完成唯一标识数据库数据上传工作,向下游企业或者使用单位提供唯一标识信息,探索建立唯一标识在产品追溯中的应用模式,形成相应的操作规范。
同时,医疗器械经营企业和医疗机构也需要按规定做好UDI工作,在经营活动和临床使用、支付收费、结算报销等临床实践中积极应用唯一标识,实现产品在流通环节和临床环节的可追溯。
**05、国内UDI实施时间?**
2019年唯一标识试点实施 **心脏、颅脑植入物、假体类等高风险植(介)入类医疗器械**
2021年1月前需完成第一批医疗器械唯一标识实施 实施品种:9大类69个品种的三类医疗器械
2022年6月前需完成第二批医疗器械唯一标识实施 实施品种:所有三类医疗器械
2022年-2024年 海南、福建、四川、北京、天津等省市进行二类医疗器械实施
2024年6月前需完成第三批唯一标识实施 实施品种:15大类103个品种的二类医疗器械
**06、UDI实施流程有哪些?**
根据《医疗器械唯一标识系统规则》规定,注册人/备案人实施唯一标识的流程为:
\*\*第一步:\*\*注册人/备案人按照《规则》和相关标准,结合企业实际情况选择发码体系和发码机构。
UDI公共平台兼容GS1和MA两种编码体系,可根据企业需求进行选择。
\*\*第二步:\*\*注册人/备案人按照发码机构的标准创建产品标识,并确定该产品生产标识的组成。
UDI公共平台平台根据编码规则可批量生成DI和PI,算法自动生成无需进行编码检测。
第三步:《规则》实施之日起,申请医疗器械注册、注册变更或者办理备案的,注册人/备案人应当在注册/备案管理系统中提交产品标识。
若企业产品处于医疗器械产品注册阶段,可借助UDI公共平台提前生成UDI-DI信息用于注册备案时提交。
\*\*第四步:\*\*注册人/备案人根据发码机构标准选择适当的数据载体,对医疗器械最小销售单元和更高级别的包装或医疗器械产品上赋予医疗器械唯一标识数据载体并进行检测识读。
通过平台生成的DI和PI数据进行标签设计(可采用一维码或二维码),并由平台老师指导企业根据实际情况进行标签打印与合规赋码,在赋码完成后进行标签检测成功后方可进行出入库。
\*\*第五步:\*\*注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。
UDI公共平台直接对接药监局数据库,企业仅需点击一键申报,即可实现DI数据上传。
\*\*第六步:\*\*产品标识及数据相关信息变化时,注册人/备案人及时更新医疗器械唯一标识数据库。
企业通过UDI公共平台即可快捷进行产品数据更新或变更。
通俗来说即:①选择发码机构②生成产品DI③注册备案申报④标签打印赋码检测⑤上传数据库⑥注册/备案变更。
**07、UDI有哪些后续应用?**
UDI是医疗器械在生产、经营、使用全链条各环节联通的基础,可实现医疗器械在全流程的精确识别和记录。
对于生产企业来说,UDI公共平台自动为企业搭建数据库,可以对接企业信息化管理设备,一个平台即可管理所有编码。
同时,企业可在UDI数据库的基础上开展一系列应用,比如对产线高改造,进行赋码关联管理(前置与后置),出入库管理应用,建立产品追溯体系,防窜货与防伪、经销商管理系统、医院UDI管理系统等,全面提升企业信息化水平与综合管理能力,助推医疗器械产业高质量发展。
更多UDI相关资料可在官网表单页进行领取!
**08、UDI实操遇到问题无法解决?**
UDI公共平台作为发码服务机构提供全流程的UDI专家指导服务,一对一指导帮助企业解决问题。企业可通过UDI公共平台电话、官网、微信、邮箱方式等进行沟通咨询。
电话:400-8700-997
官网:https://udi.idcode.net/
邮箱:udi@idcode.net
微信:f72704132801


UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


