UDI常见问题与解答(第十期)
2021-04-02
**1、UDI标签/条码设计原则?**
答:
(1)如使用RFID,则须同时附带一维条码或二维码标签。
(2)标签不能仅有码图,需要同时附有中文标识说明。
(3)标签印刷质量符合ISO15415标准的C级以上。
(4)UDI编码与码图扫码内容须一致、正确。
(5)符合 AIDC 与 HRI 原则。
------------
**2、UDI标签/条码的张贴要求?**
答:
医疗器械唯一标识数据载体应当满足自动识别和数据采集技术以及人工识读的要求自动识别和数据采集技术包括一维码、二维码或者RFID电子标签等形式。数据载体应当位于标签、外包装或医疗器械本体上。
目前UDI载体相关详细规定如下:
1.应将UDI 载体(UID 的AIDC 和HRI 标示)放置在标签上或器械本体上以及所有更高级别的器械包装上。更高级别的包装不包括运输容器。
2.若使用单元(UoU)包装的器械上有明显的空间限制,UDI 载体可放置在更高级别的包装上。
3.对于一次性使用的,I 和IIa 类器械的独立包装,可不要求UDI 载体出现在包装上,但应出现在更高级别的包装上,如包含几个单独包装器械的纸箱。但当医疗保健提供者不能获得(家庭保健用途)更高级别的器械包装,UDI 应放置在独立器械的包装上。
4.对于零售网点(POS)销售的器械,AIDC 中的UDI-PI 可不需要出现在销售点包装上。
5.若存在限制条件时,不能同时使用AIDC和HRI时,要求只放AIDC;家庭护理产品,优先放HRI。
6.可重复使用的器械本体上应带有UDI 载体。需要在患者使用之间进行消毒、灭菌或重新清理的可重复使用器械的UDI 载体在每次进行处理以使器械准备好在器械的整个预期使用寿命内进行后续使用之后应是长期的和可读的。本节的规定不适用于满足以下任一条件的任何器械:
(a) 任何类型的直接标记将对器械的安全或性能造成干扰;
(b) 该器械不能直接标记,因为其在技术上并非切实可行。
7.UDI 载体在器械正常使用和预期使用寿命内应是可读的。
8.若UDI 载体容易通过器械的包装或在AIDC 可扫描的情况下读取,则无需将UDI 载体放置在包装上。
9.若由多个部件组成且在首次使用前必须完成装配的单独成品器械,则其UDI 载体仅需放置在器械的一个部分上。
10.UDI 载体的位置应合理,以使在正常操作或储存期间可进行AIDC。
11.包括“UDI-DI”和“UDI-PI”的条形码载体还可包含器械操作的基本数据或其他数据。
------------
**3、UDI标签/条码的制备与产线方案相关?UDI条码如何打印出来?**
答:
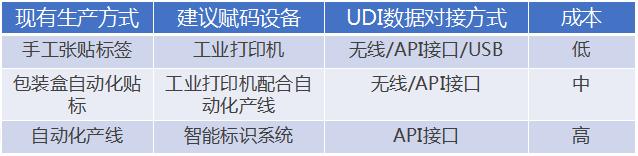
------------
**4、医疗器械UDI条码下面的数字代表什么意思?**
答:
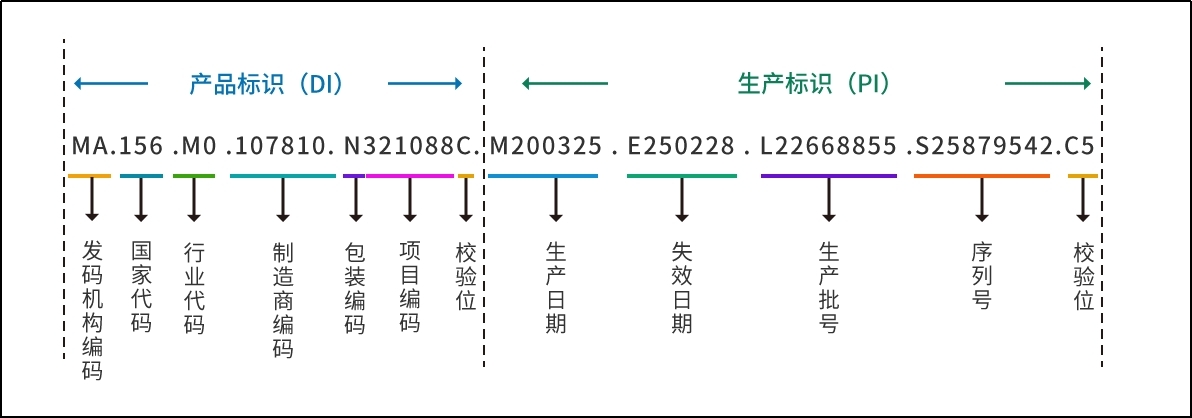
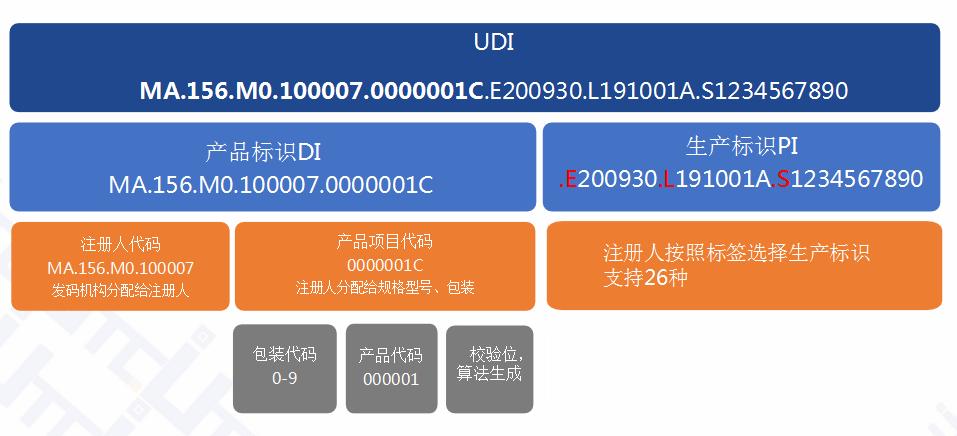
------------
为帮助大家快速了解行业政策和信息、UDI公共平台精心准备了下列资料,供大家参考学习
领取方式:关注微信公众号“UDI公共平台”、回复“资料”,点击链接填写表单选取所需资料,工作人员收到后将尽快发送相关内容。(公众号会持续更新行业资料与实时消息)
上一篇:UDI常见问题与解答(第十一期)
下一篇:UDI常见问题与解答(第九期)
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


