UDI常见问题与解答(第一期)
2021-03-29
**1、什么是医疗器械唯一标识UDI?**
**答:**
UDI(Unique Device Identification)又叫医疗器械唯一标识,是一串由符号、数字或者字母组成的代码,一般附着在医疗器械产品和包装上。它是医疗器械唯一标识系统中最重要的一环,具备全球唯一性,可用于医疗器械产品的精准识别,便于监管和追溯,所以也被称为医疗器械产品的“数字身份证”。
UDI存在于医疗器械产品生产、流通、使用的整个生命周期中,是精准识别医疗器械信息的基础。它的实施将会减少市场中对医疗器械识别不足的障碍,迅速并准确地识别出器械安全和有效性的关键信息,减少因此带来的医疗差错。
同时,UDI系统可以提高医疗器械不良事件报告的质量,更有效地识别产品问题,更迅速地召回问题器械,以确保患者的安全。
------------
**2、在医疗器械UDI中,DI和PI是什么?有什么作用?是必要的吗**
**答:**
根据相关编码规则,UDI由产品标识(DI)和生产标识(PI)两部分组成:
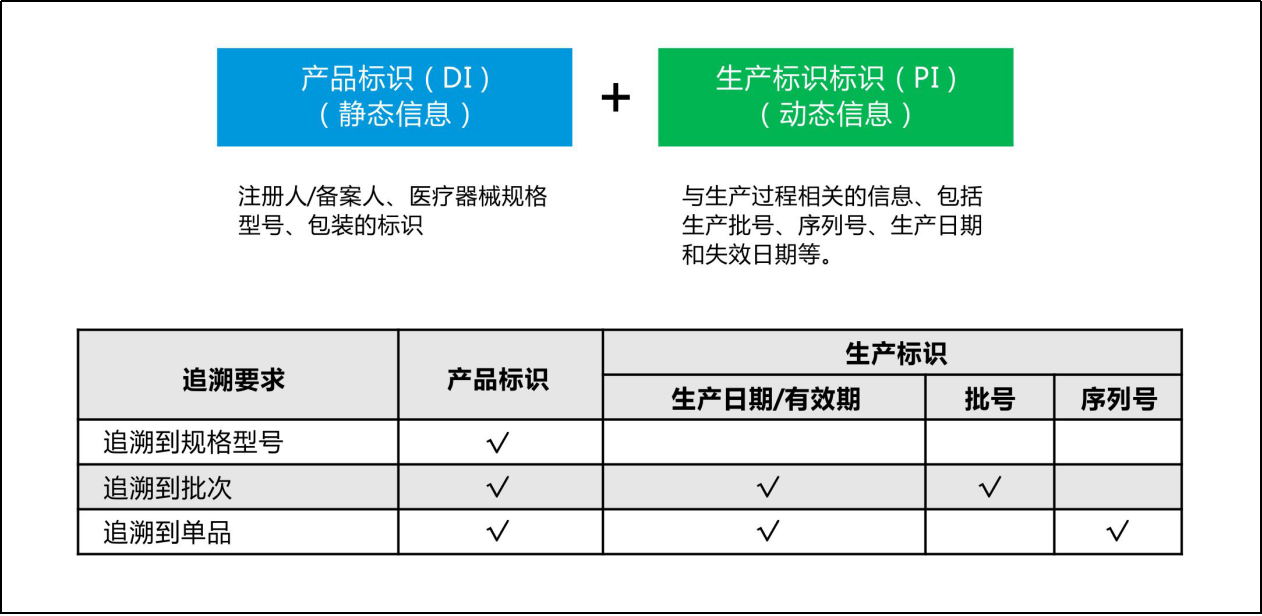
DI是产品静态信息,包括企业编码和产品ID。其中,企业编码由备案人申请,由符合我国医疗器械编码规则和标准的发码机构发出的,是具备唯一性的编码;产品ID是一段包含具体产品名称、包装等级、规格型号的编码。因此,由企业编码和产品ID组合而成的DI具备全球唯一性。
PI是产品动态信息,包括生产日期、失效日期、生产批次、序列号、校检位等。目前,PI编码暂不需要上传到药监局数据库,各使用单位可采用扫描设备直接获取产品相关生产信息。
------------
**3、目前国家对医疗器械UDI落实范围的具体要求是什么?企业实施UDI工作有没有截止时间?具体是什么时候?**
**答:**
根据国家药品监督管理局2019年10月15日发布的《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》要求,“2020年10月1日起,生产列入首批实施目录的医疗器械,应当具有医疗器械唯一标识”。
对于其他非试点企业,目前暂无具体要求时间,但建议提前做好战略准备,为未来UDI工作全面实施奠定基础。
截止目前,国家尚未颁布准确推行政策,但已有部分省市开始推行全面试点。
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


