安徽省三部门联合发文,鼓励企业开展UDI工作!
2021-03-29

近日,安徽省药品监督管理局、安徽省卫生健康委员会与安徽省医疗保障局发布**《关于联合推进第一批医疗器械唯一标识实施工作的通知》**,着力推进UDI工作的落实。
**各有关单位:**
根据国家药监局综合司、国家卫生健康委员会办公厅《关于印发医疗器械唯一标识系统试点工作方案的通知》(药监综械注[2019]56号)和国家药监局、国家卫生健康委、国家医保局《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)要求,医疗器械唯一标识系统试点工作已于2020年12月31日结束,第一批唯一标识实施工作于2021年1月1日启动。依据国家药监局相关工作文件及医疗器械唯一标识试点总结暨第一批实施工作部署视频会议精神,为深入推动我省唯一标识实施工作,结合我省实际,现将有关事项通知如下:
**一、第一批医疗器械唯一标识实施工作范围**
**(一)实施品种**
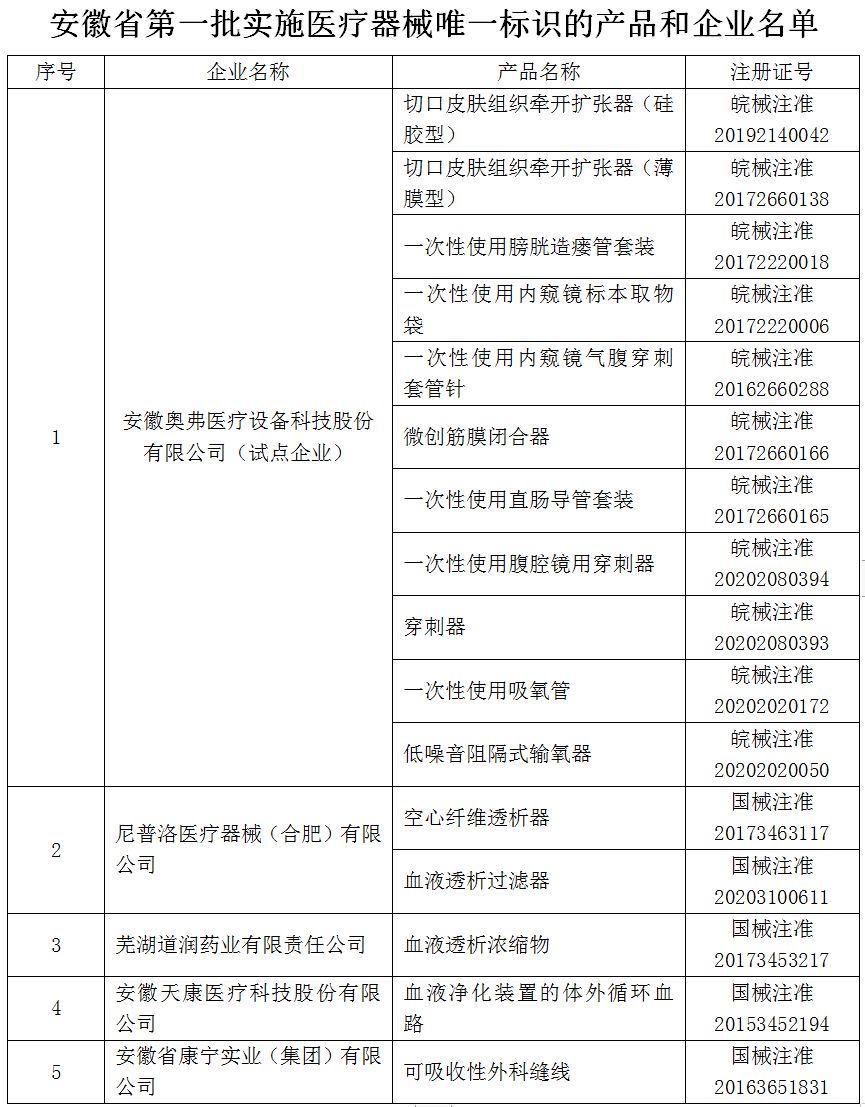
按照国家药监局、国家卫生健康委、国家医保局《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)所列九大类69个高风险第三类医疗器械品种(见附件1),确定我省第一批实施医疗器械唯一标识品种(见附件2)。具备条件的我省其他第二、三类医疗器械产品生产企业也应积极参与,对其生产的品种实施医疗器械唯一标识相关工作。
**(二)实施单位**
国家药品监督管理局公布的第一批参与唯一标识系统试点单位、第一批实施品种生产企业以及相关经营企业和使用单位,均应按照要求开展医疗器械唯一标识实施工作。同时,鼓励省内有条件、有意愿的医疗器械生产企业、经营企业和使用单位参与。
**二、相关单位职责分工**
**(一)医疗器械注册人**
制定本单位实施方案,按照唯一标识系统规则、标准和时间节点,对其产品创建和赋予唯一标识,完成唯一标识数据库数据上传工作,向下游企业或者使用单位提供唯一标识信息,并对数据的真实性、准确性、完整性负责。与经营企业或使用单位积极交流,探索建立唯一标识在产品追溯和医保结算中的应用模式,形成相应的操作规范。
**(二)经营企业**
制定本单位实施方案,形成医疗器械经营业务中应用唯一标识的工作流程以及唯一标识数据库数据与业务系统的对接操作流程,验证多码并行的操作性。探索与医疗器械注册人、使用单位、监管部门的协同机制,及时反馈对接应用过程中存在的问题。
**(三)使用单位**
做好唯一标识与医疗业务系统的对接工作,探索唯一标识与医疗器械管理、临床应用等系统的衔接。
**(四)安徽省医疗器械行业协会**
及时组织企业进行相关业务知识培训和政策宣贯。负责组织第一批实施品种以外的医疗器械注册人、经营企业和使用单位积极参与医疗器械唯一标识试点工作,收集和汇总企业的反馈意见,提出建议。
**(五)安徽省医疗保障局**
负责研究医疗器械唯一标识试点品种在医保结算中的应用模式,根据需要对接医疗器械唯一标识系统与安徽省医药集中采购平台,会同安徽省药品监督管理局、安徽省卫生健康委员会研究解决医疗器械唯一标识信息化系统数据连接和衔接出现的问题,同时做好与国家医疗保障局的工作衔接。
**(六)安徽省卫生健康委员会**
会同安徽省药品监督管理局组织本省医疗器械使用单位参与唯一标识实施,探索唯一标识在日常卫生健康管理中的应用模式和方法,同时做好与国家卫生健康委的工作衔接。
**(七)安徽省药品监督管理局**
负责督促本省医疗器械注册人、经营企业积极开展实施工作,探索唯一标识在医疗器械日常监管工作中的应用(医疗器械生产监管处、药品医疗器械流通监管处负责);做好与国家药品监督管理局信息中心的工作衔接,提供相应的技术支持,协调研究解决数据对接过程中的有关问题。(科技发展处负责);协调各单位研究解决实施过程中的有关问题,组织开展政策宣传和相关培训(许可注册处负责),探索唯一标识在医疗器械不良事件报告和监测环节的应用(省药品不良反应监测中心负责)。
**三、有关工作要求**
**(一)高度重视**
实施医疗器械唯一标识工作是落实医疗器械审评审批制度改革任务,加强医疗器械全生命周期管理,提升医疗器械监管和卫生管理效能的重要手段,是创新医疗器械治理模式,进一步保障公众用械安全的关键举措,各单位要充分认识实施工作的重要意义,加强协调,密切合作,指派专人负责,确保实施工作的顺利开展。
**(二)落实部门职责**
医疗器械唯一标识系统工作涉及多方参与,是跨部门、跨领域的项目,各单位应按照本通知要求,认真做好涉及本部门的医疗器械唯一标识相关工作,同时,积极沟通交流,加强协作配合,做到信息互通、资源共享,形成工作合力。鼓励有条件的参与单位开展相关研究合作,探索形成从源头生产到最终临床使用的全链条联动。
**(三)加强技术保障**
医疗器械唯一标识系统工作专业性、技术性强,需要强有力的技术保障。各方要充分利用相关领域的技术力量,以支持各参与单位开展实施工作,并为后期全面推行唯一标识制度提供长效的技术支撑保障。
**(四)注重经验总结**
各单位应及时沟通实施过程中的重要问题,有针对性的提出意见、建议,形成可推广、可复制的工作经验,保障医疗器械唯一标识实施工作稳步、有序推进。
**四、联系人**
◆安徽省药品监督管理局
袁媛 0551-62999796
◆安徽省卫生健康委员会
胡声锁 0551-62998063
◆安徽省医疗保障局
顾青 0551-69029736
**五、附表**
来源:安徽省药监局官网
为帮助各大企业进一步了解医疗器械UDI,对实施问题答疑解难,**UDI公共平台近期还将举办一系列讲座。**
**扫码关注公众号,及时获取课程信息!**

**往期推荐**
预报名 | 《医疗器械UDI白皮书》即将发布,现在报名优先免费领取!
新版发布| 2021.03版医疗器械唯一标识UDI政策法规汇编(中国版)免费领!
重磅!《医疗器械监督管理条例(修订草案)》正式通过!
政策解读|福建省《关于全面推进医疗器械唯一标识系统建设工作的通知》

UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


