公益培训|2021(第二届)大湾区医疗器械唯一标识(UDI)
2021-03-09

**峰会背景**
2019年7月1日,国家药品监督管理局会同国家卫生健康委员会联合印发《医疗器械唯一标识系统试点工作方案》;8月26日,国家药监局发布《医疗器械唯一标识系统规则》,进一步规范医疗器械唯一标识系统建设;2020年9月30日,国家药品监督管理局发布了唯一标识系统试点时间延长至2020年12月31日,从原来的9大类64个品种的基础上又增加了5种风险产品纳入了第一批实施产品目录中。第一批实施唯一标识的医疗器械注册人将于2021年1月1日起,严格按照《医疗器械唯一标识系统规则》等相关要求开展产品赋码、数据上传和维护等工作。
2020年12月30日,中广汇智·UDI公共平台联合中国(深圳)公共卫生产业暨生物医药博览会(简称PIE)组委会以及相关单位举办了首届大湾区医疗器械唯一标识(UDI)峰会及培训。大会培训辅助人数达300人次,现场来自国外全领域的相关服务机构高级指导讲师、国内试点知名企业和知名医院代表、欧盟UDI合规服务机构等共13位重量级讲师莅临。PIE-UDI峰会由中国(深圳)公共卫生产业暨生物医药博览会(简称PIE)组委会主导,是致力服务国内医疗器械全行业完善建设国际医疗器械唯一标识UDI实施的专业产业链服务平台,是目前最具规模及影响力的线下会议。
为帮助企业解决UDI实施过程中的问题,中广汇智·UDI公共平台再次联合大湾区医疗器械唯一标识(UDI)峰会及培训组委会(PIE-UDI峰会,定于2021年3月12日在深圳坪山中城生命科学园举办 “医疗器械唯一标识(UDI)合规实操公益培训”,培训班将围绕UDI设计、从宏观政策到具体标准,从基本概念到应用实施,针对UDI编码、UDI标签设计、上报数据库、UDI扩展应用、产品溯源防伪等全方位手把手教学实施UDI。
**参会对象**
1.医疗器械生产企业从事注册、研发管理、质量法规、临床及生产相关人员;
2.科研单位从事医疗器械创新研发与管理的相关人员;
3.医疗机构从事医疗器械临床试验及质量监管工作的相关人员;
4.从事医疗器械项目投资、临床及注册咨询服务等有关人员;
**参会时间**:2021年3月12日
**参会地址**:深圳.坪山.深城投&中城生命科学园
**议题议程**
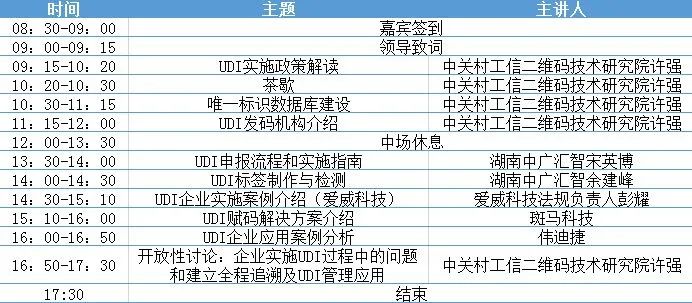
**机构简介**
中广汇智·UDI公共平台是由中关村工信二维码技术研究院(ZIIOT)授权自主研发的一站式UDI申报平台,以中关村MA码为核心,兼容GS1等多种码制,直接向企业发放合规UDI编码。同时,平台对接药监局数据库、企业ERP和产线设备,提供基于UDI发码、编码、申报、核验、赋码等一系列全流程服务。
**培训优势**
1、权威的组织单位——国家药监局指定的官方发码机构
2、领域内资深专家团队
3、UDI实施全流程解决方案
4、一站式难点痛点解决
**组织机构**
**1、主办单位**
中广汇智·UDI公共平台
大湾区医疗器械唯一标识(UDI)峰会及培训组委会
**2、协办单位**
深城投&中城生命科学园
**3、支持单位**
湖南中广汇智信息技术有限公司
爱威科技股份有限公司
真珍斑马技术贸易(上海)有限公司
伟迪捷(上海)标识技术有限公司
**4、承办单位**
筑信产业会展(深圳)有限公司
**温馨提示**
此次峰会属于公益培训,将有机会与资深专家直接面谈沟通,因而坐席有限,每家报名企业限名额1-2人,敬请谅解!
**UDI公益培训会报名入口**(长按识别进入)

为帮助各大企业答疑解难,尽快完成UDI实施,**UDI公共平台近期将举办一系列讲座**。
扫码关注公众号,及时获取课程信息!


UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


