医疗器械注册/备案人UDI实施流程解析和团队分工参考!
2023-11-07
《国家药监局 国家卫生健康委 国家医保局关于做好第三批实施医疗器械唯一标识工作的公告(2023年第22号)》中规定:2024年6月1日起列入第三批实施产品目录的医疗器械应当具有医疗器械唯一标识。
根据往年第二批医疗器械唯一标识的实施推进情况参考,如今已至10月,逐渐步入医疗器械唯一标识实施的高峰期,医疗器械企业须在最后这段时间内抓紧完成UDI的实施。
为帮助企业在规定时间内更好更快的完成UDI的实施,以下为中广汇智UDI公共平台为大家介绍的医疗器械UDI实施流程与医疗器械注册人企业的内部分工安排。
***
医疗器械唯一标识实施基本实施流程
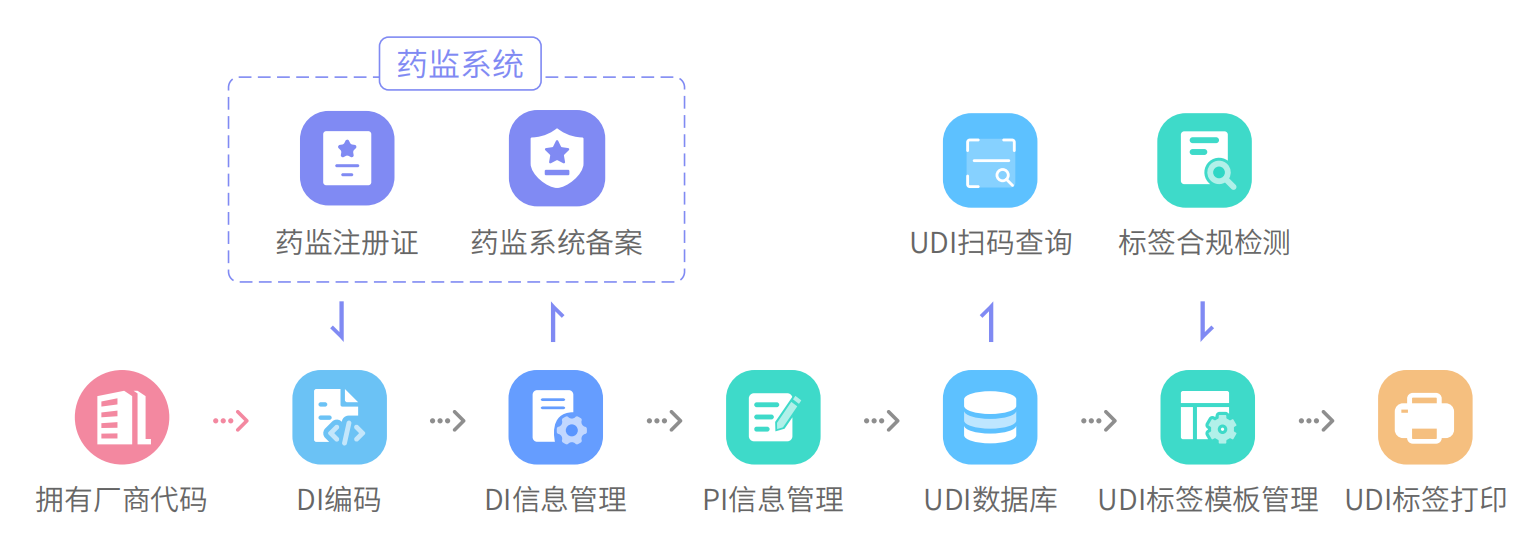
1、注册人/备案人按照《规则》和相关标准,结合企业实际情况选择发码机构和编码体系。
2、注册人/备案人按照发码机构的标准创建产品标识(DI),并确定该产品生产标识(PI)的组成。
3、注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。
4、注册人/备案人根据发码机构标准选择适当的数据载体和标签模版,完成UDI标签打印,并对医疗器械最小销售单元和更高级别的包装或医疗器械产品上赋予医疗器械唯一标识数据载体。
5、注册人/备案人在产品出库前对已赋码产品UDI标签进行扫码检测验证,确保产品UDI无误。
***
## 企业各部门分工参考
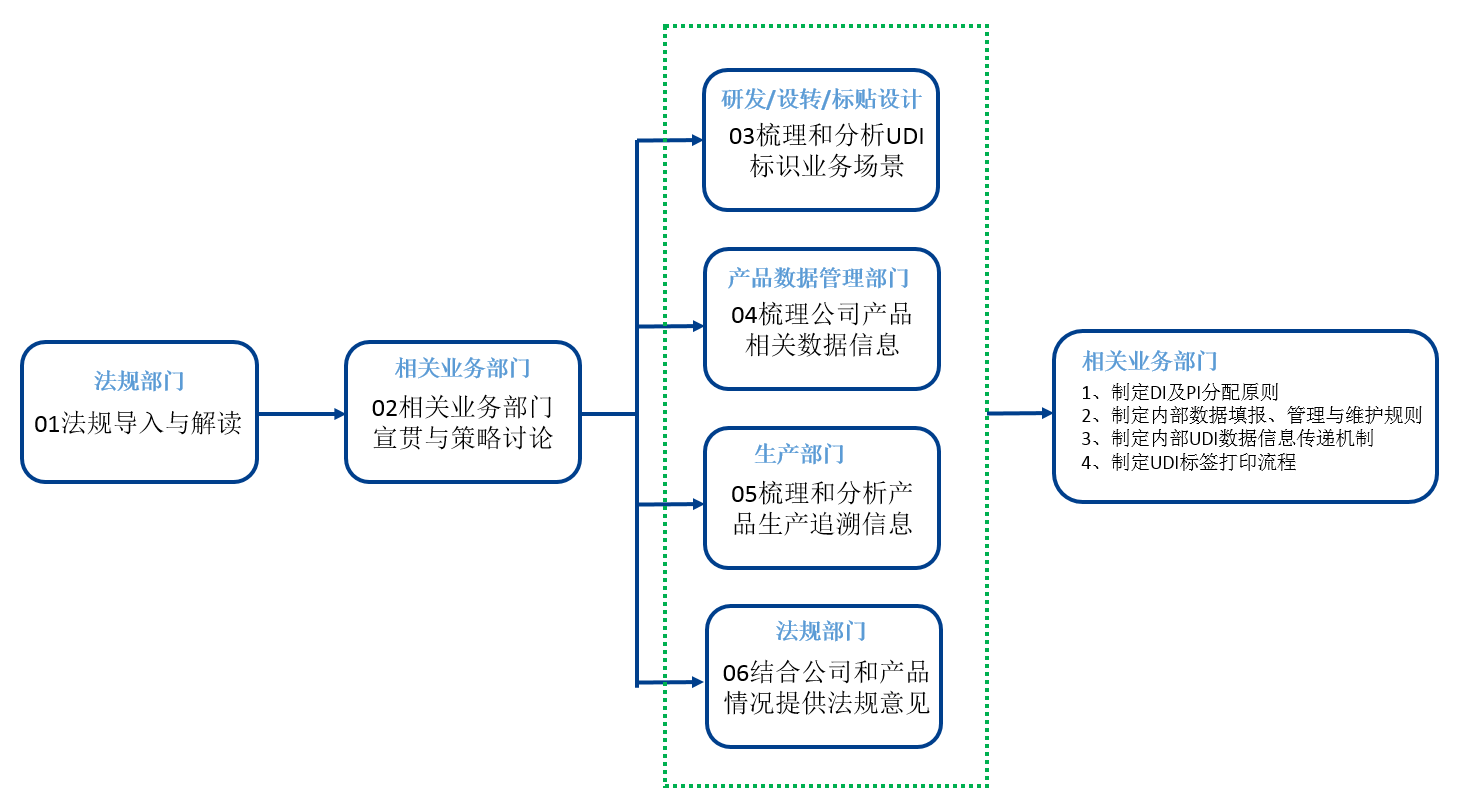
1、 法规部门负责法规导入与解读,并结合公司和产品实际情况提供专业的法规意见;
2、 相关业务部门进行宣贯与策略讨论;
3、 研发和工艺设计部门负责梳理和分析UDI标识业务场景;
4、 产品数据管理部门负责梳理公司产品相关数据信息;
5、 生产部门负责梳理和分析产品生产追溯信息;
6、 相关业务部门负责UDI执行的流程,包括制定DI及PI分配原则、制定内部数据填报、管理与维护规则、制定内部UDI数据信息传递机制、制定UDI标签打印流程等。
***
## 企业UDI管理流程建立
1、 研发部门确立新产品立项或者引入新的物料。
2、 法规部门判断是否使用UDI,满足以下条件即需要执行UDI。
(1) 公司作为注册人或备案人
(2) 公司在售产品被纳入医疗器械唯一标识实施目录
(3) 公司产品即将或正在进行注册备案
3、 相关业务部门需要确定使用的UDI编码体系并在相应发码机构进行编码申请,生成UDI-DI编码并完成UDI-PI编码,将UDI信息通知工艺技术和生产部门。
4、 工艺技术部门选择并确定UDI载体类型,设计UDI标签模版。
5、 生产部门根据模版打印UDI载体并根据标签与工艺要求完成粘贴(或者进行喷码)。
6、 法规部门在药监局唯一标识数据库中完成注册申报,须在注册系统中填写完整的UDI-DI和其他相关信息并进行申报。
7、 质量部门需要要检查UDI载体上相关信息的正确性,可采用PDA等设备进行标签检测。
注意:由于每个公司的内部情况各部相同,不同公司可视实际情况确定不同业务部门的具体职责,以上流程分工安排仅供参考!
当然以上流程均可在中广汇智UDI公共平台的指导下完成,平台全程参与并服务企业的UDI实施流程,帮助企业高效快速的完成UDI合规实施。同时,根据企业生产管理需要,可以提供基于UDI的包装关联、出库防窜、防伪追溯等定制化应用,帮助企业提升智能化生产管理效能。
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


