4个项新规 |《医疗器械注册与备案管理基本数据集》等征求意见发布!
2022-07-07

近日,国家药监局发布关于公开征求《医疗器械注册与备案管理基本数据集》等4个标准意见的通知。
为贯彻落实《国务院办公厅关于全面加强药品监管能力建设的实施意见》(国办发〔2021〕16号),规范医疗器械信息系统建设与数据交换共享,国家药品监督管理局信息中心组织编制了《医疗器械注册与备案管理基本数据集》《体外诊断试剂注册与备案管理基本数据集》《医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)》《医疗器械(含体外诊断试剂)监管信息基础数据元值域代码(注册和备案部分)》4个标准的征求意见稿(见附1-4)。
附:
1.医疗器械注册与备案管理基本数据集(征求意见稿)
2.体外诊断试剂注册与备案管理基本数据集(征求意见稿)
3.医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)(征求意见稿)
4.医疗器械(含体外诊断试剂)监管信息基础数据元值域代码(注册和备案部分)(征求意见稿)
「关注公众号“**UDI公共平台**”,后台回复关键词:【数据集】,即可查看下载附件全文。」
------------
此前,《医疗器械唯一标识系统规则》中第十五条要求:注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库。
本次《医疗器械注册与备案管理基本数据集》《体外诊断试剂注册与备案管理基本数据集》《医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)》等3个标准中也将医疗器械唯一标识纳入注册与备案管理数据中。
------------
## 《医疗器械注册与备案管理基本数据集》
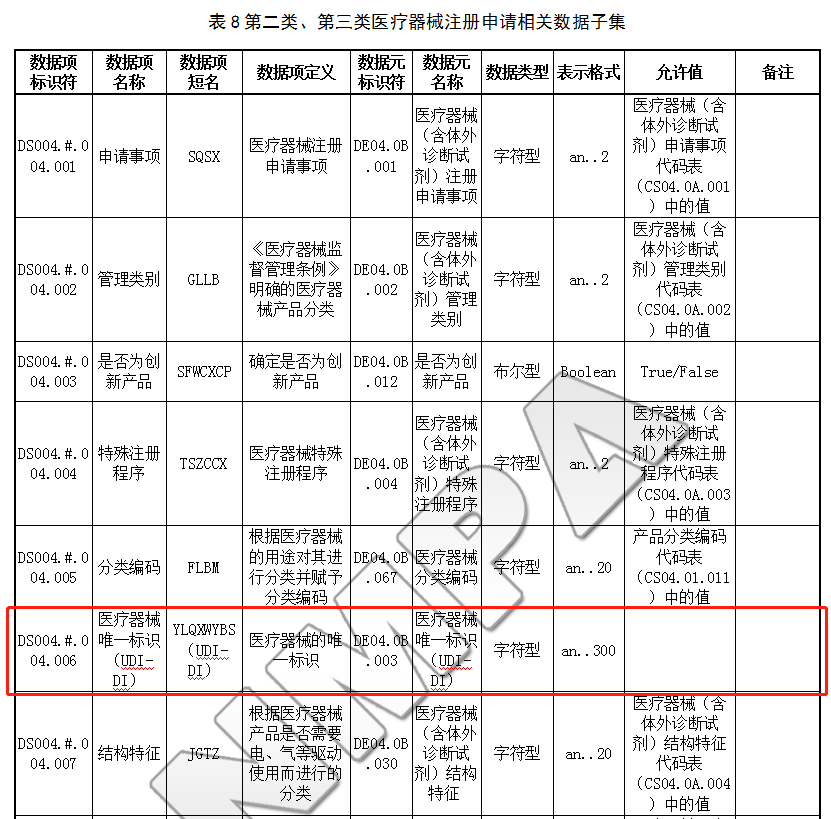
6.2.1 第二类、第三类医疗器械注册申请相关数据子集
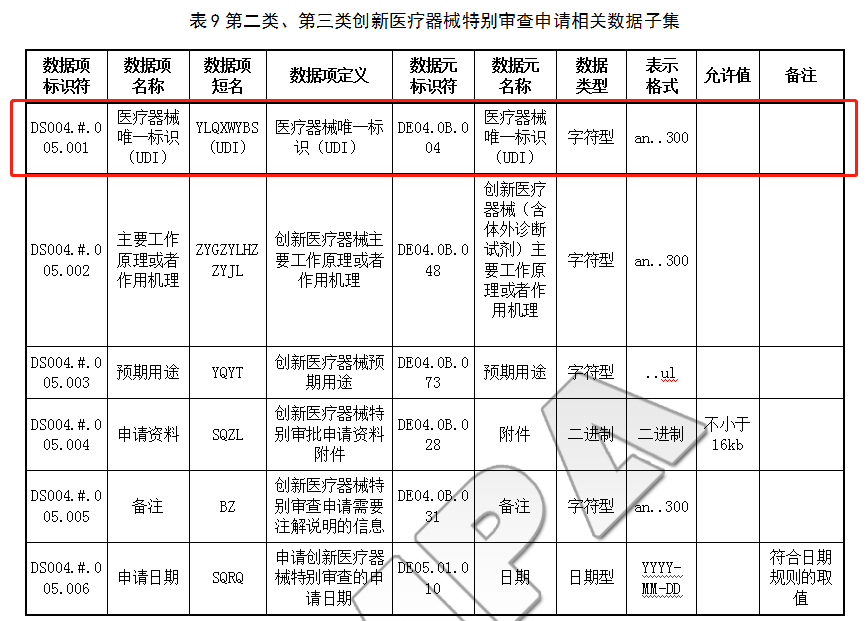
6.2.2 第二类、第三类创新医疗器械特别审查申请数据子集
第二类、第三类创新医疗器械特别审查申请相关数据子集符合除符合6.1.1和6.1.3中涉及医疗器械产品和注册人基本信息外,还包括:创新医疗器械唯一标识(UDI)、受托企业生产许可证和委托协议、申请资料和申请日期等,具体见表9:
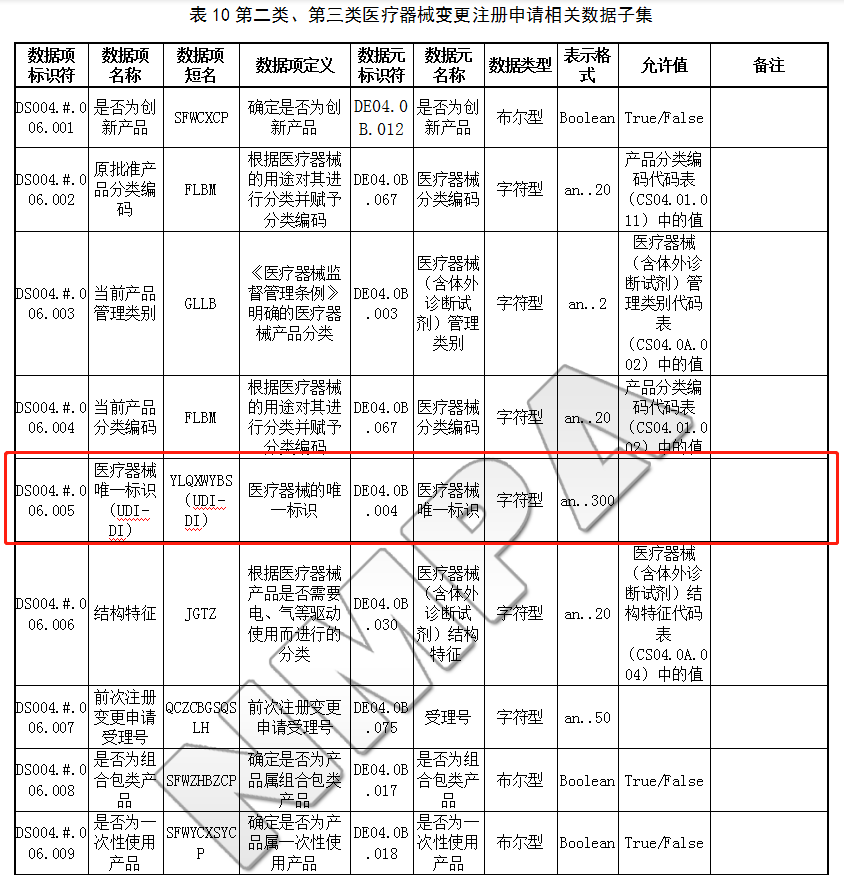
6.2.3 第二类、第三类医疗器械变更注册申请数据子集
------------
## 《医疗器械注册与备案管理基本数据集》
6.2.1 第二类、第三类体外诊断试剂注册申请相关数据子集
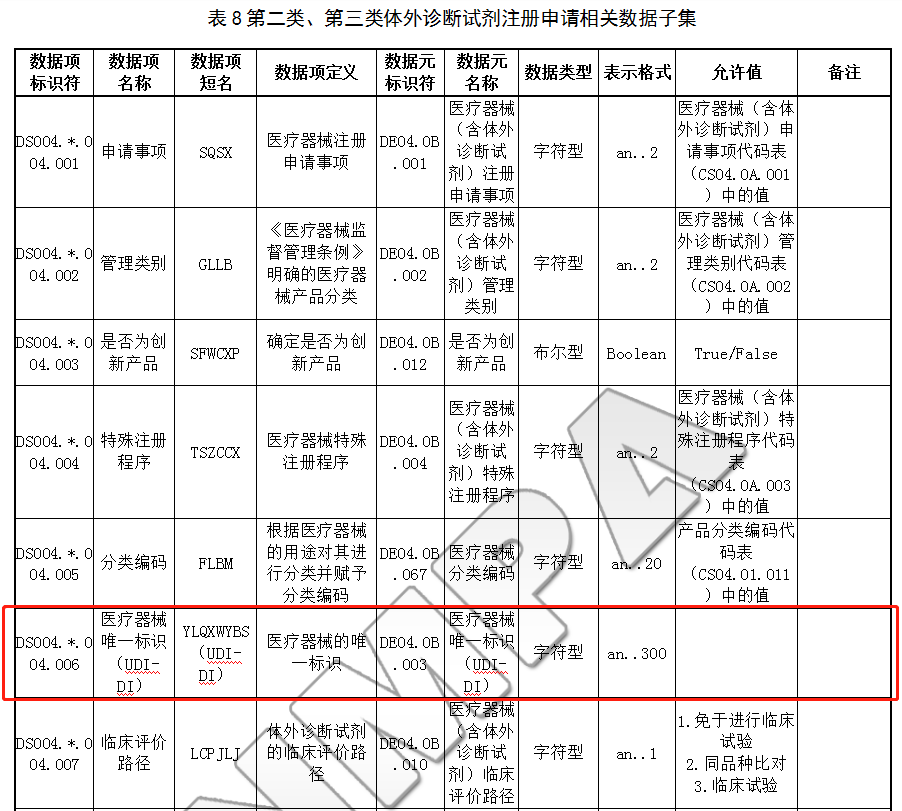
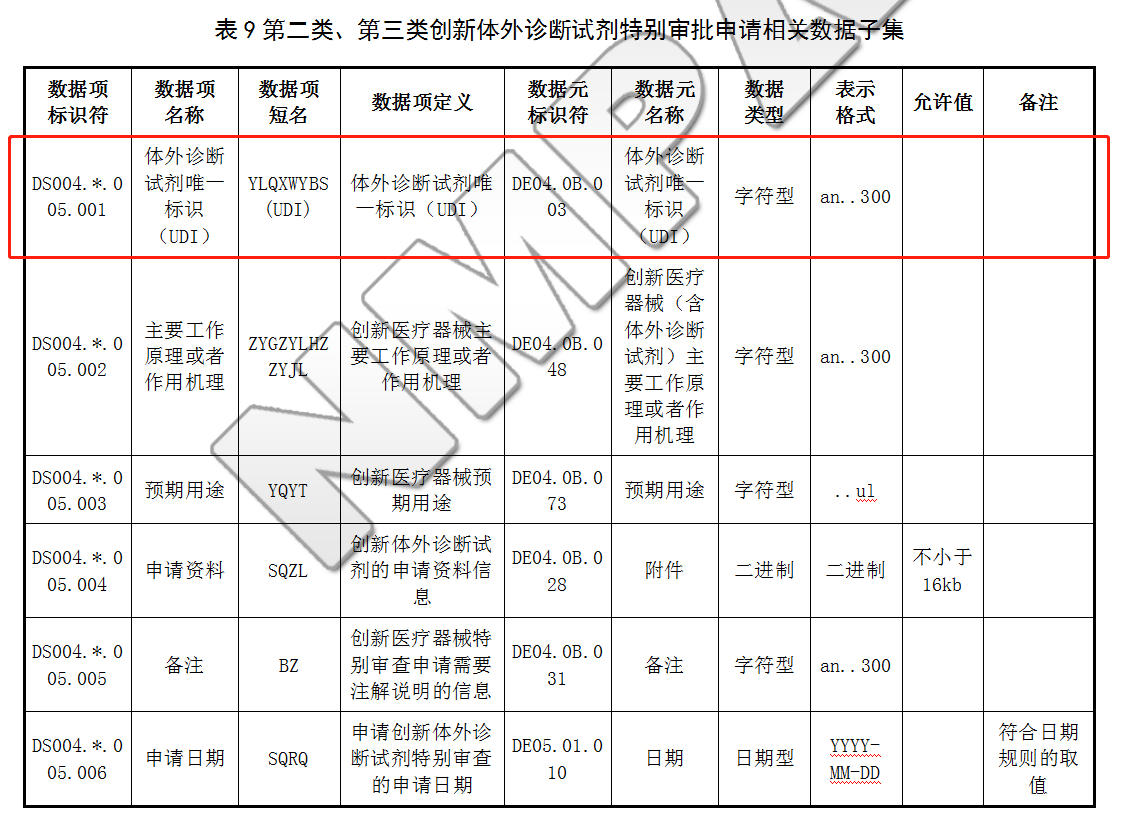
6.2.2 第二类、第三类创新体外诊断试剂特别审批申请相关数据子集
第二类、第三类创新体外诊断试剂特别审批申请相关数据子集除符合6.1.1和6.1.3中涉及体外诊断试剂产品和注册人基本信息外,还包括:创新医疗器械唯一标识(UDI)、申请资料和申请日期等,具体见表9:
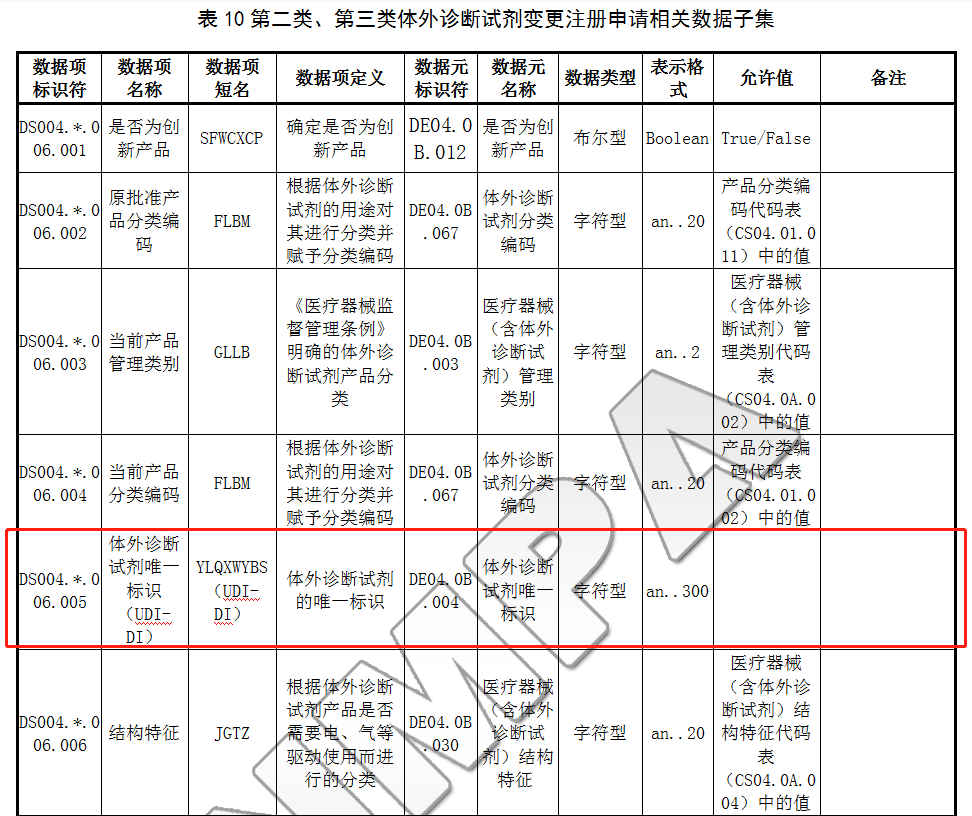
6.2.3 第二类、第三类体外诊断试剂变更注册申请相关数据子集
------------
## 《医疗器械(含体外诊断试剂)监管信息基础数据元(注册和备案部分)》



来源:国家药监局官网
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


