药监局数据库UDI申报数据实现600000+条!
2021-06-30

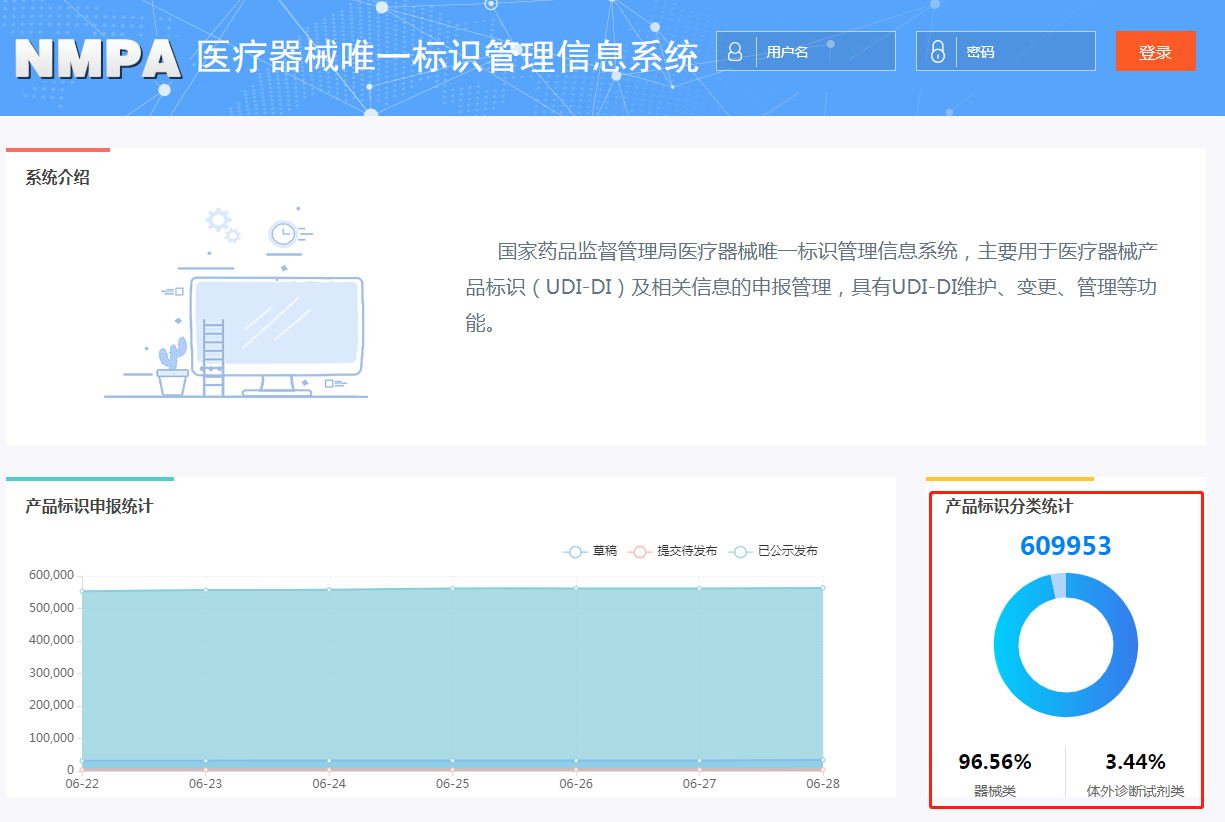
随着UDI试点的深入,UDI也逐渐取得了相应的一些成果。目前,药监局数据库UDI申报数据已经实现600000+条,且仍在持续增长中,基本实现第一批试点范围的全覆盖,逐步向更大范围扩展。这一数字既是开始,也意味着企业实施UDI的步伐在不断加快,即将进入高速发展期。
纵观近几年UDI从想法到落实,实现从0到1的搭建,离不开各方的共同努力。在政府、发码机构、企业、医疗机构等共同努力下,扎实推进了唯一标识实施工作,积极探索唯一标识在医药、医疗、医保等领域的拓展应用,持续提升医疗器械全生命周期全链条管理效能,为维护公众用械安全持续做出贡献。
国家政策导向坚定,强制要求UDI体系实施
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院办公厅《深化医药卫生体制改革2019年重点任务》,国家药品监督管理局会同国家卫生健康委员会开展医疗器械唯一标识系统试点工作,制定发布了《医疗器械唯一标识系统试点工作方案》,从指导思想、基本原则、明确了UDI实施的各项要求。
发码机构坚守职责,大力推动UDI宣传实施
试点伊始,各发码机构就开始积极行动起来。尤其是中关村旗下UDI公共平台始终坚守作为发码机构的责任,积极承担了UDI全国范围的宣传推广工作。阶段性的在全国范围内开展UDI公益培训会议,为企业普及UDI相关知识,帮助企业理清UDI实施要点与难点。有效指导企业开展唯一标识创建、赋码工作,为企业排忧解难。
企业自身积极响应,试点企业已基本完成UDI实施工作
在国家政策的要求下,发码机构的倡导下,许多企业目前已将UDI纳入年度重点工作计划中,纷纷咨询了解UDI相关问题与实施流程。目前相关试点企业已基本完成UDI实施工作,第一批试点工作逐渐步入尾声。
医疗器械唯一标识(UDI)一直是国际医疗器械监管领域关注的热点,是监管手段创新和效能提升的发展方向。UDI作为重要的基础性工作,在信息化、互联网+、大数据时代,与当前监管领域的热点如追溯体系建设、三医联动、医疗器械再评价等都紧密相关。
建立UDI系统不仅有助于避免和减少医疗器械的误用、便于召回,从而大大降低社会成本,还有助于改善库存控制、完善报销方式并减少假冒产品,更是实现智慧监管的有效途径。
此次药监局数据库申报数据突破60000条既意味着UDI实施初见成效,也意味着UDI即将作为基础正式成为链接各方拓展应用的基石。在未来,中广汇智UDI公共平台将继续以专业的素养和优质的服务帮助企业完成UDI实施,持续扩充药监局数据库,协助打通医疗器械全生命周期全链条,为实现公众用械安全继续努力。

UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


