敲响警钟 | 某司器械产品因UDI追溯问题被召回!
2025-07-15
据药监局发布公告,某司因产品只能通过手工报表进行UDI追溯而主动召回!虽然本次召回涉及的产品未进口至中国,但事件也为行业敲响警钟!
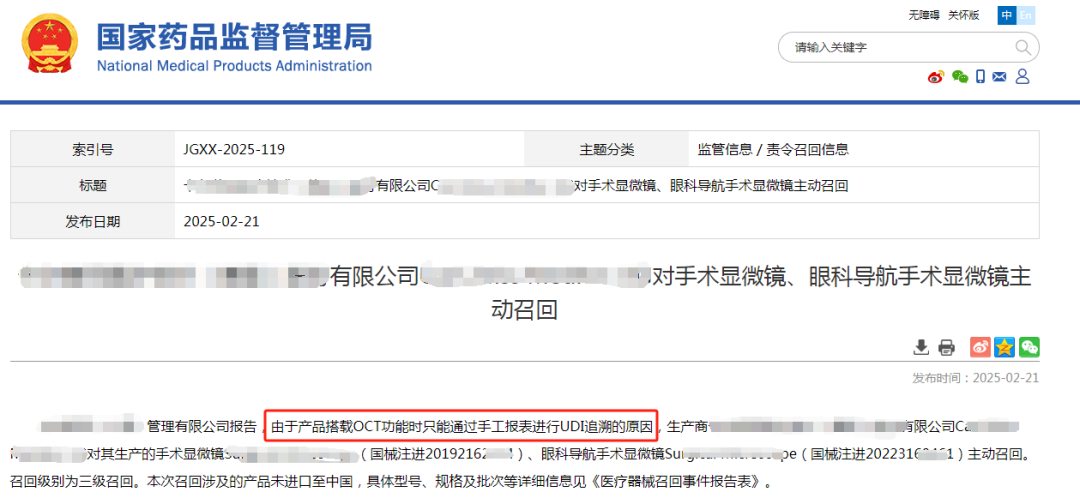
UDI(唯一器械标识)是医疗器械全生命周期管理的关键,随着UDI的全面推广,UDI已然成为医疗器械产品的标配,不论是在经营还是使用过程中都会涉及到,手工操作易导致数据滞后或错误,影响产品追溯效率与监管合规性。此次召回虽为三级(低风险),但暴露了企业UDI系统建设的短板。企业应高度重视UDI合规工作,严格按照国家药监局相关要求,建立健全UDI管理体系,确保产品UDI标识的唯一性、准确性和可追溯性。
为做好UDI合规工作,医疗器械生产企业应重点做好以下几方面工作:
1、提高认识,加强培训。 企业应充分认识到UDI合规的重要性,加强对相关法规标准的学习,提升员工UDI合规意识和能力。
2、建立健全UDI管理体系。 企业应建立覆盖产品全生命周期的UDI管理制度,明确各部门职责,规范UDI标识的申请、分配、使用和管理流程。
3、选择合适的UDI载体。 企业应根据产品特点和实际需求,选择合适的UDI载体,如二维码、条形码等,并确保UDI标识清晰、可读、耐用。
4、加强信息化建设。 企业应加强信息化建设,建立UDI数据库,实现UDI信息与生产、流通、使用等环节信息的互联互通,提升UDI数据管理效率。
5、积极配合监管部门工作。 企业应积极配合监管部门开展UDI监督检查,及时整改存在的问题,确保UDI合规工作落到实处。
UDI合规是医疗器械生产企业必须履行的责任和义务,也是保障公众用械安全的重要举措。企业应高度重视,主动作为,切实做好UDI合规工作,为构建安全、有效的医疗器械监管体系贡献力量。
***
此外,监管部门也应加强对医疗器械生产企业UDI合规的监督检查,加大对违法违规行为的惩处力度,推动UDI制度全面有效实施,切实保障公众用械安全。
最后,一起来回顾下《医疗器械生产监督管理办法》中未实施UDI相关的规定!
第七十九条 有下列情形之一的,由药品监督管理部门依职责责令限期改正;拒不改正的,处1万元以上5万元以下罚款;情节严重的,处5万元以上10万元以下罚款:
(一)未按照本办法第十六条的规定办理医疗器械生产许可证登记事项变更的;
(二)未按照国家实施医疗器械唯一标识的有关要求,组织开展赋码、数据上传和维护更新等工作的。
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


