UDI注册?
2020-09-02
注册人/备案人实施唯一标识注册的流程为:
第一步:注册人/备案人按照《规则》和相关标准,结合企业实际情况选择发码机构。
中关村工信二维码研究院(ZIIOT )是国际标准化组织(ISO)、欧洲标准委员会(CEN)、国际自动识别与移动技术协会(AIM Global)三大国际组织共同认可的国际代码发行机构,发行代码(IAC)为“MA”,负责 IDcode 体系管理维护,代码“MA”将首先用以向全球用户发放二维码标识。
为了履行代码发行机构的职责、更好的服务全球,ZIIOT 主导成立了“统一二维码标识注册管理中心(UTC Global)”向全球统一提供二维码代码发行和注册服务,是 IDcode体系的管理机构,负责开展国际二维码代码发行工作、认可评定体系建立等工作。
第二步:注册人/备案人按照发码机构的标准创建产品标识,并确定该产品生产标识的组成。
MA(IDcode)医疗器械唯一标识编码规则:
UDI= 产品标识(DI静态信息注册人/备案人、医疗器械规格型号、包装的标识) + 生产标识(PI动态信息与生产过程相关的信息,包括生产批号、序列号、生产)
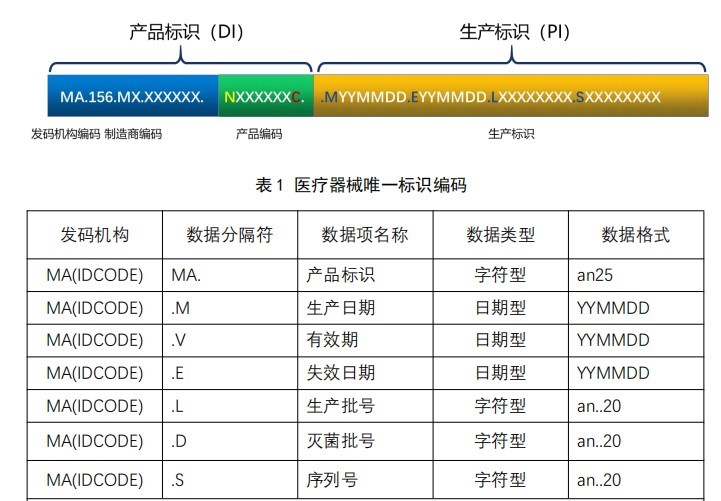
第三步:《规则》实施之日起,申请医疗器械注册、注册变更或者办理备案的,注册人/备案人应当在注册/备案管理系统中提交产品标识。而且注册人要实时关注产品动态,产品信息发生变化时, 及时在数据库中更新相关信息,以保持数据库产品信息的真实准确性。
第四步:注册人/备案人根据发码机构标准选择适当的数据载体,对医疗器械最小销售单元和更高级别的包装或医疗器械产品上赋予医疗器械唯一标识数据载体。
现在市场上常用的数据载体包括一维码、二维码和射频标签(RFID)。注册人/备案人可根据产品的特征、价值、主要应用场景等因素选择适当的医疗器械唯一标识数据载体。

最小销售单元就是包含完整UDI的最低包装等级,不同的包装级别,都需要对应的唯一二维码标识。
第五步:注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。
唯一标识数据库由国家药品监督管理局组织建设,由注册人/备案人将唯一标识的产品标识及关联信息按照相关标准和规范上传至数据库,并对数据的准确性、唯一性负责。医疗器械经营企业、医疗机构、政府相关部门及公众可通过数据查询、下载、数据对接等方式共享唯一标识数据。

第六步:产品标识及数据相关信息变化时,注册人/备案人及时更新医疗器械唯一标识数据库。
通过 ZIIOT 的 UDI 发码平台,可以“最快速度,最低成本,最简操作”一站式解决上述所有问题。
申请试用
为了帮助各企业尽快实施UDI,中关村工信二维码技术研究院(ZIIOT)作为药监局指定发码机构,面向全国医械企业开展UDI试点征集。试点期间优惠政策如下:
① 试点企业所有产品免费编码,包括DI与PI;
② 免费为试点单位完成药监局数据库数据报送(数据长期有效);
③ 免费指导试点企业完成赋码与打码;
④ 免费提供UDI实施培训与咨询;
⑤ 免费指导试点企业完成UDI与ERP等信息系统对接;
⑥ 协助试点企业对接一线赋码设备厂商;
咨询电话:0731-86366048

UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


