一步到位|UDI整体解决方案概述!
2024-04-03

医疗器械唯一标识(Unique Device Identification,简称UDI)是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
当前,根据国家药监局相关政策条例规定,医疗器械注册人/备案人开展医疗器械唯一标识系统建设相关工作。医疗器械生产企业作为医疗器械注册人/备案人是UDI制度实行的第一责任方。
> 2021年1月1日,9大类69种第三类医疗器械第一批实施医疗器械唯一标识。
> 2022年6月1日,其他第三类医疗器械(含体外诊断试剂)第二批实施医疗器械唯一标识。
> 2024年6月1日,纳入产品目录的15大类103种二类医疗器械应当具有医疗器械唯一标识。
对于医疗器械生产企业来说,UDI实施的整体解决方案主要涵盖UDI申报、UDI赋码和UDI应用三个阶段。
值得一提的是,从合规角度出发,UDI申报和UDI赋码两个阶段的实施更为重要;但从企业数智化应用与发展的角度出发,UDI应用阶段的实施将发挥更大的作用。
***
## 一、UDI申报阶段
完成整个UDI申报内容还有不少前置工作,不仅包括UDI政策法规学习、UDI岗位人员配置、UDI操作流程了解、企业产品梳理等准备工作,也包括获取UDI发码、UDI-DI编码分配与生成、UDI数据库上传以及UDI-PI生成等具体流程。
***
### 1.准备工作
**UDI政策法规学习**:UDI是政策驱动类的工作,在实施UDI之前,需仔细研读政策法规的内容,了解其规定与处罚,以避免合规风险。
**UDI岗位人员配置**:UDI贯穿了医疗器械全生命周期,与企业各岗位工作息息相关,企业在配置UDI岗位工作人员时需从法规、生产、质量等角度综合考虑。
**UDI操作流程了解**:在正式进行UDI实施前,企业可详细了解UDI实施的必要流程与操作环节,以加快实施效率,减少实操问题。
**企业产品资料梳理**:UDI申报时需填写各类产品数据,包括产品标识信息、产品基础信息。生产标识信息等内容,因此提前进行企业产品资料的梳理可加快UDI申报效率。
以上准备工作企业可自行开启也和选择中广汇智UDI公共平台合作获取更多前期准备资料和老师咨询与指导。
***
### 2.实操流程
**申请发码**:企业实施UDI的第一步需确定选择使用的UDI编码体系,并在对应的发码机构申请发码。
**UDI-DI编码分配与生成**:拿到发码机构获取的基础代码后,需结合产品信息根据相对应的UDI编码规则进行UDI-DI的编码与分配,直至生成完整合规的UDI-DI。
**UDI数据库上传**:将生成的UDI-DI和相关产品资料在国家药监局数据库进行填写与上传,审核通过后即完成了UDI申报。
**UDI-PI生成和管理**:在编码阶段,UDI-DI编码生成后可根据企业的生产信息同步生成UDI-PI,DI+PI构成完成的UDI成为后续赋码的基础。企业需要妥善保管完整的UDI编码,便于后期查询使用。
***
## 二、UDI赋码阶段
UDI赋码也并不仅仅只是UDI码的张贴工作,既要选择好所需的赋码设备并进行调试,也要设计合适的UDI标签样式,两者准备完毕方可正式进行赋码实操工作,UDI码制作完成后还需要进行识读验证无误,才算是完成整个UDI赋码内容。
**UDI赋码设备选择**:在UDI赋码前,企业需清点自身所拥有的硬件资产,根据企业生产环境等因素评估企业现有的硬件设施是否满足赋码的需要。若缺少UDI赋码的硬件设备,企业需及时补齐。
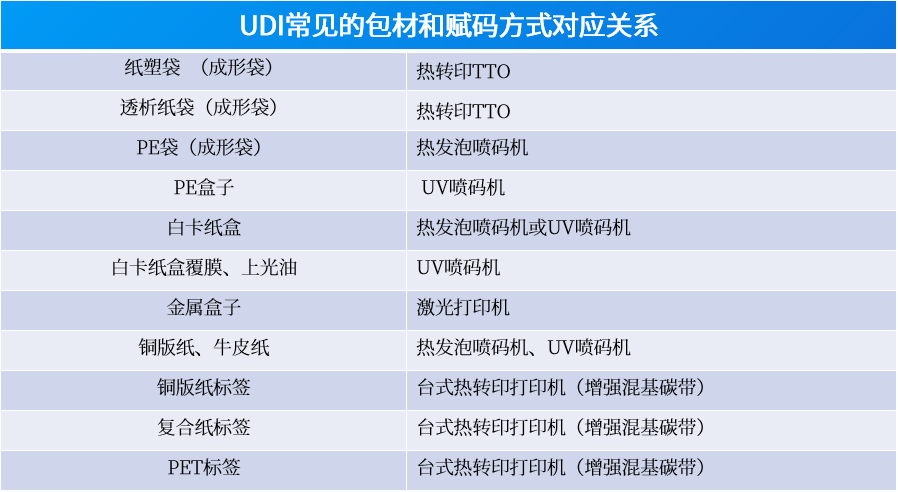
**UDI标签的设计**:UDI的赋码应符合YY/T 1879-2022 《医疗器械唯一标识的创建和赋予》的要求,同时UDI标签也需符合《医疗器械说明书和标签管理规定》的要求,因此企业在进行UDI标签设计时不仅要考虑样式美观与标签位置,更重要的是符合法规要求。
**UDI赋码实操**:根据企业选定的赋码设备组合,在UDI赋码实操时一般有手动贴码和自动化喷码两种方式,企业根据此前选定的方案直接执行即可。
**UDI码检测**:赋码完成后企业可选择将印制(打印)好的包装小样送到具有检测能力的机构进行检测或者直接购置专业设备自行检测识读。从产量、方便程度以及长期成本等方面考虑,一般建议企业自购设备进行检测。
在上述内容中,关于UDI赋码设备选择的影响因素、标签模版的设计与选择、识读检测设备的应用与采购等相关问题,企业可咨询中广汇智UDI公共平台获取硬件配置方案。
***
## 三、UDI应用阶段
产品的出库往往意味着工作已经告一阶段,但并不代表结束。医疗器械产品事关生命安全,一旦在流通和使用中出现产品问题,生产企业都脱不了责。为了企业更好的监控和管理产品,加载各类UDI应用不仅能帮助企业掌握产品全链路动态,也是实现企业数智化升级的助力。目前,常见的UDI应用一般包括包装关联、防窜预警、防伪追溯等。
**包装关联**:对于企业来说,大部分产品都具有多层级的包装形式,包装关联应用则是通过绑定不同包装等级之间的UDI数据,实现产品在仓储、运输和配送环节可识别、可记录、可追溯,从而解决重复扫码出入库的情况,提高产品流转效率。
目前,UDI 4.0提供前置关联和后置关联两种应用,可充分适配不同企业情形。

**防窜预警**:通过UDI码配置防窜预警应用,可实现防窜功能。通过后台数据可以追踪经销商和产品流向信息,监督每批产品去向与销售状态和区域,出现窜货问题及时预警,一码打通全部数据,大大简化企业操作,让窜货不再难防,帮助企业稳定产品价格体系和流通区域管控。
**防伪追溯**:通过UDI体系,可以实现医疗器械的全生命周期追溯,包括生产、流通、使用等各个环节。防伪追溯应用的建立不仅可以实现产品溯源,更在于帮助企业建立严格的追溯管理制度,来实现对防伪信息的查询和验证,保护产品的真实性和安全性。
UDI的实施是基础性工作,可应用于医疗器械的生产、流通、使用等各个环节,既与产品质量息息相关,也关系着产品追溯的进一步发展。
基于UDI发展的追溯管理体系对于保障医疗器械产品的质量和安全具有重要意义,随着追溯技术的不断发展和市场需求的变化也将对更多企业形成冲击,更多企业内部进行的数智化产线改造有望成为未来风潮。
**更多UDI相关问题可咨询官网客服,还可获取更具有针对性的企业UDI整体解决方案!**
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


