重点关注 | 5月26日起,这4类医疗器械产品出口欧盟必须具备UDI!
2023-06-25

医疗器械唯一器械标识(UDI)对医疗器械全生命周期中的唯一身份标识。通过医疗器械唯一标识,建立医疗器械信息化追溯系统,可实现医疗器械的不良事件报告、产品召回及追踪追溯等。在信息时代,UDI是国际医疗器械监管先进手段,也是医疗器械实现全球可追溯的“通用语言”。随着UDI逐渐成为各国各地区监管部门加强医疗器械可追溯性管理的标配,已然是产品出口全球皆必需的“身份证”。
目前,全球不少国家均已制定UDI政策法规,规定或强制要求:在本国销售、流通的医疗器械上执行UDI标识,欧盟也是如此。根据欧盟医疗器械法规MDR规定:对于已纳入UDI实施范围的医疗器械及体外诊断设备在欧盟境内上市销售时,需要在实施日期之前完成UDI标识,并体现在医疗器械标签、包装或器械本身。
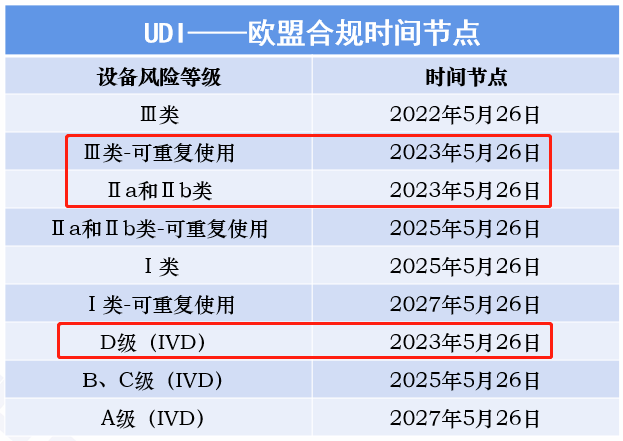
自欧盟新版医疗器械法规颁布以来,已有植入式器械及Ⅲ类器械的UDI工作纳入实施。随着2023年5月26日的临近,欧盟UDI实施范围将扩展至Ⅱa、Ⅱb类器械和Ⅲ类-可重复使用器械、D级体外诊断试剂。对于有计划出口这4类器械产品到欧盟的企业,需要抓紧时间实施UDI了。此外,对于欧盟UDI实施的其他类器械产品实施时间,也整理在下方,供大家参考。
根据欧盟医疗器械法规要求,欧盟UDI实施流程大概包括以下5个环节。
***
### 1、申请并获取厂商代码
可通过中国物品编码中心的官网线上申请,也可以前往中国物品编码中心各分支机构线下申请。
***
###
### 2、生成Basic UDI-DI
Basic UDI-DI是是EUDAMED数据库中与设备相关的信息的主要访问键,用于连接具有相同预期用途、风险等级、基本设计和制造特征的器械。产品相关文档中也需要列明Basic UDI-DI,这些文件包括但不仅限于:CE证书、欧盟符合性声明、CE技术文件等。与UDI-DI不同的是,它没有任何数据载体,不会出现在产品及包装、标签上。
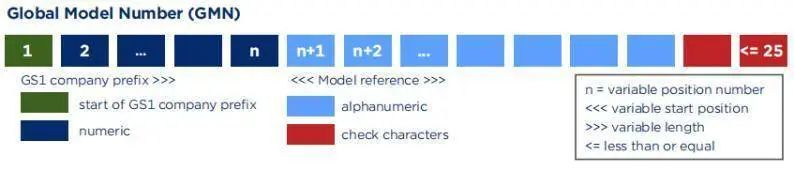
Basic UDI-DI的组成包括厂商识别代码(数字)+内部型号参考代码(字母数字)+校验码,字符长度不超过25位。
***
### 3、分配UDI-DI和UDI-PI
UDI码包含两个部分:产品标识(DI)和生产标识(PI)。DI主要是用来区分产品的规格型号和包装层级,而PI是用来识别医疗器械产品生产过程中的各项关键数据,如生产日期、失效日期等。应确保DI长度为14位,如果不是,请在GTIN前面补零。

***
### 4、注册欧盟医疗器械数据库(EUDAMED)
在EUDAMED注册为经济运营商,并获得制造商SRN,然后申请Eudamed信息录入员账号,录入Basic UDI和UDI-DI的数据信息。
***
### 5、选择合适的UDI载体
企业根据器械类型和追溯所需信息,选择合适的UDI载体,如:一维码、二维码、RFID射频标签。三种数据载体各有优势,不过目前来说,用二维码来作为标识载体更适合较多企业的需求。还有一点要注意的是,产品是否需要直接标记。例如,5月26日以后,Ⅲ类-可重复使用器械应采用本体标识。
***
UDI实施对于企业而言,存在各国政策法规难吃透、实施细节多、实施周期长等难点,有相关出口需求的企业,为避免后期产品流通不畅,需要预留足够的UDI实施时间,建议企业避免“卡点”实施,以免造成不必要的成本浪费,早做准备,提早合规完成UDI的实施工作。
目前,中广UDI公共平台为企业提供出口欧盟的医疗器械产品UDI相关实施指导服务内容,有需要的企业可咨询官网客服。
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


