关注 | 这类医疗器械由Ⅰ类调整为Ⅱ类,4月1日起正式执行!
2023-03-31

此前,国家药监局发布了调整《医疗器械分类目录》部分内容的公告(2022年第25号)和(2022年第30号),分别对02-15-14夹子装置等10种医疗器械产品和27类医疗器械内容进行了调整。

国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第25号)其中提到:2022年1月1日前已按照2017版《医疗器械分类目录》办理第一类医疗器械产品备案的, 2023年4月1日前产品备案继续有效;自2023年4月1日起,该类产品未依法取得医疗器械注册证不得生产、进口和销售。相关生产企业应当切实落实产品质量安全主体责任,确保上市产品的安全有效。

国家药监局关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)其中提到:自2024年4月1日起,射频治疗仪、射频皮肤治疗仪类产品未依法取得医疗器械注册证不得生产、进口和销售。自2024年4月1日起,未取得医疗器械生产、经营许可(备案)的企业,不得从事相关产品的生产和销售。
需要注意的是,《医疗器械分类目录》新调整的部分内容中有部分产品管理类别等级提升,风险程度更高。尤其是公告中着重强调的由**Ⅰ类调整为Ⅱ类**管理的“14-10-08液体敷料、膏状敷料”中非无菌提供、通过在创面表面形成保护层,起物理屏障作用,用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理的液体敷料、膏状敷料类产品,以及09-07-02射频治疗(非消融)设备中射频治疗仪、射频皮肤治疗仪类产品。
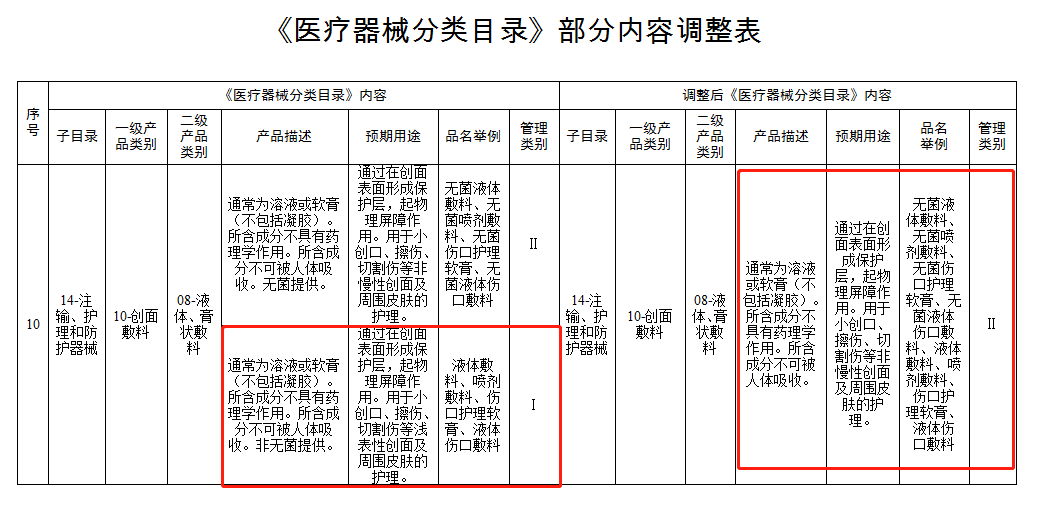
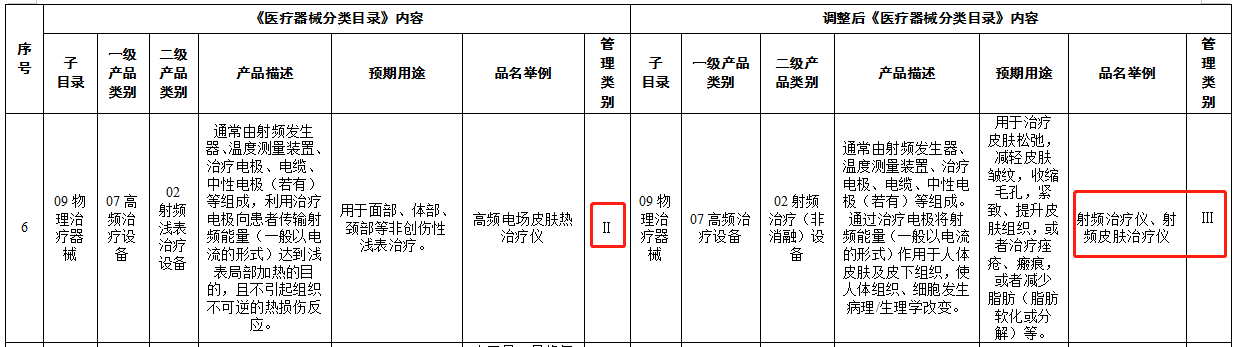
这意味着自2023年4月1日起,生产、销售未依法取得医疗器械注册证的液体敷料、膏状敷料类产品和射频治疗仪、射频皮肤治疗仪类产品,将依据《医疗器械监督管理条例》第八十一条的规定,**由负责药品监督管理的部门没收违法所得、违法生产经营的医疗器械和用于违法生产经营的工具、设备、原材料等物品**;违法生产经营的医疗器械货值金额不足1万元的,并处5万元以上15万元以下罚款;货值金额1万元以上的,并处货值金额15倍以上30倍以下罚款;情节严重的,责令停产停业,10年内不受理相关责任人以及单位提出的医疗器械许可申请,对违法单位的法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,**并处所获收入30%以上3倍以下罚款,终身禁止其从事医疗器械生产经营活动**。
此外,医疗器械产品风险等级的变化不仅意味着企业在注册经营和销售等方面的变化,生产环节还需要注意按照相关规定完成UDI的实施。
UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


