国家药监局公告:162种医疗器械产品被批准注册(附产品名单)
2021-08-13

近日,国家药品监督管理局发布公告,2021年7月累计共批准注册医疗器械产品162个。其中,境内第三类医疗器械产品96个,进口第三类医疗器械产品29个,进口第二类医疗器械产品32个,港澳台医疗器械产品5个(具体产品见附件)。
**2021年7月批准注册医疗器械产品目录**
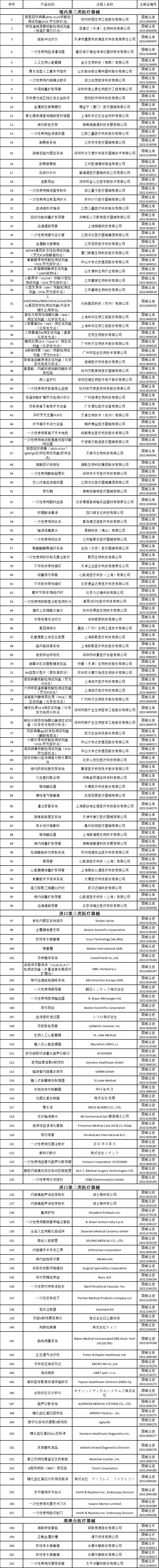
整体上此次被批准注册的医疗器械产品以三类为主,包含境内与境外,约占全部批准注册产品的三分之二。
不久前,国药监发布《关于做好第二批实施医疗器械唯一标识工作的公告》征求意见稿,其中对三医疗器械实施UDI的时间和内容做了明确规定,各医疗器械注册人应时刻谨记相关要求,以免遗漏错过。
目前正值UDI推进时期,对于新批准注册的医疗器械来说,实施UDI是真正投入市场前绕不开的前提,各医疗器械生产企业应提前做好准备,及早完善UDI实施。尤其是新注册的三类器械更应抓紧时间,将UDI列为重点筹备工作。
新医疗器械产品注册前后与UDI有何关联,如何进行UDI实施?新医疗器械产品何时何处需要UDI码?企业如何借助UDI完善后期应用,提升信息化管理水平?……以上问题皆可咨询UDI公共平台进行了解。

UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


