办理注册证需要UDI-DI,UDI申报又需要注册证该如何解决
2021-07-13

据统计,目前为止已有一千多家企业基本完成了UDI的实施。但也有一些即将实施UDI的企业仍处于对UDI的了解学习中,对一些具体要求往往是“知其然却不知其所以然”,因而经常会出现一些疑惑。
比如某些产品还未正式上市的企业就出现了这样的问题:通过一段时间的学习了解到UDI申报需要提交注册/备案的信息,但办理注册/备案时又需要提交产品标识(UDI-DI)。这就成了一个绕圈子循环往复的问题,于是部分企业表示:这难道不是自相矛盾吗?
其实要解决这个问题,那么就需要先了解这个问题产生的原因。
**一、UDI申报需要提交注册/备案信息**
这一项要求来自于UDI整体实施时的具体操作要求。
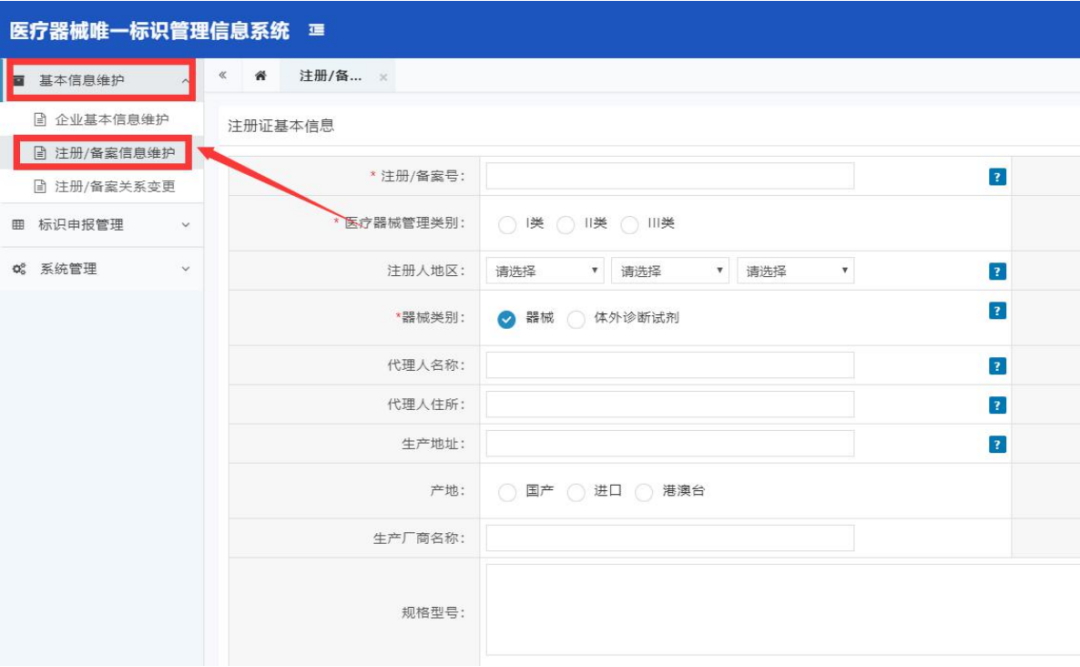
了解过UDI实施流程的企业应该很清楚,DI申报是企业实施UDI时很重要的一环。在申报 DI 编码之前,需根据法规要求,将产品的注册证号上传至国家药监局UDI系统中。要完成这一步就少不了企业产品注册/备案的信息,这也是其中的必填项。
**二、注册/备案需要提交产品标识**
这一项要求则出自于《医疗器械唯一标识系统规则》。

其中第十五条规定:注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。
这意味着企业在医疗器械注册、注册变更或者办理备案时都需要产品标识(UDI-DI)。
虽然清楚了这两项要求的具体规定,但似乎看起来仍旧是互相矛盾无解的问题?
**三、解决方法**
实际上,要想解决这个问题很简单。登录UDI公共平台官网进行注册登录,免费申请企业代码。在这一过程中,系统会根据所上传的信息与营业执照进行匹对审核,并向企业发放企业代码,该企业代码全球唯一,并长期有效。
拿到这串企业代码后,企业可选择在中广汇智UDI公共平台上预生成一个DI编码,用这份预DI编码作为医疗器械注册/备案时的资料进行填写即可,当注册/备案完成后,接下来UDI申报的问题自然也就迎刃而解了。
通过UDI公共平台,企业不仅可以快速解决上述难题,帮助完成注册证注册和UDI申报,还可以利用平台的便捷性迅速完成所有UDI实施步骤。此外,平台提供专家一对一专业指导,帮助企业解决UDI实施过程中的各项难题,节省时间与精力成本。

UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


