【UDI实操】企业实施医疗器械唯一标识常见问题(三)
2021-05-26

**(一)生产企业应如何选择医疗器械唯一标识数据载体?**
许多企业会纠结于UDI应该使用“条形码”还是“二维码”的问题,让我们先来看看它们的区别:
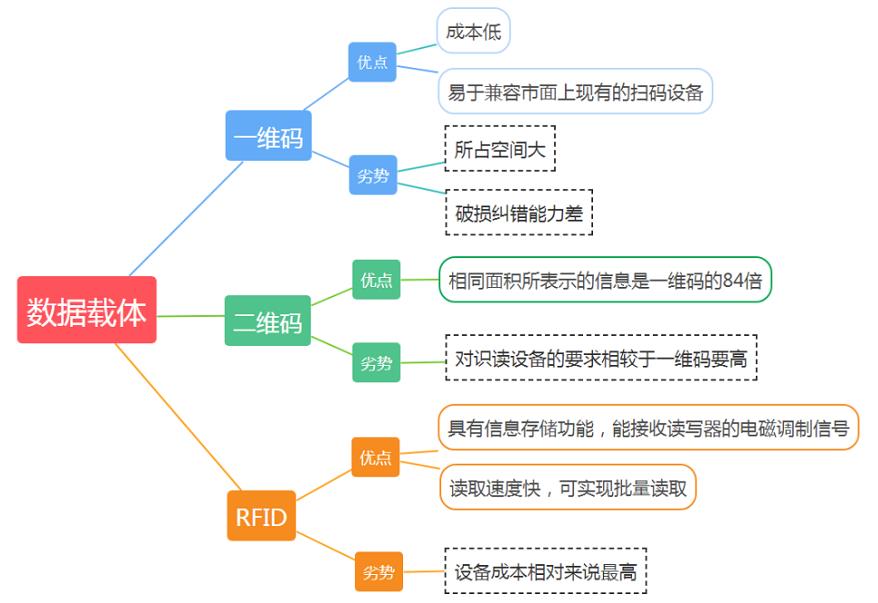
**(1)一维码(条形码)**
只在一维方向上表示信息的条码符号,成本低,能很好兼容市面上现有的扫码设备,但所占空间大(UDI条形码打印出来是传统条形码的2-3倍长),并且条形码破损纠错能力差,损坏则难以读出。
**(2)二维码**
在二维方向上都表示信息的条码符号,相比于一维码,它能够容纳更多的数据,在医疗器械包装尺寸受限的时候能发挥很大作用。同时,二维码的破损纠错能力远高于一维码。但二维码对识读设备的要求也高于一维码。
**(3)射频标签(RFID)**
内置芯片,具有信息存储功能,能接收读写器的电磁调制信号,并返回相应信号的数据载体,读取速度快,可实现批量读取,但设备成本相对来说较高。
具体选择哪种数据载体,企业可根据**自身产品的特征、价值、主要应用场景**等因素来决定。同时**应考虑并相应匹配产品接收方的扫码识读工具。**
**(二)部分医院目前据说只接受一维条形码,这种情况企业该怎么办?**
目前阶段,部分医院设备较为陈旧,存在扫码设备只能识读条形码的情况。针对这种情况,UDI公共平台专门出具了相应解决方案,确保扫码枪能准确识读出DI码。
而从长远来看,条形码问题较多,采用二维码更为便利,随着医院设备的逐步更新,二维码将越来越普及。
中广汇智·UDI公共平台可选择生成**条形码或二维码**,满足企业不同需求。
**(三)UDI标签/条码设计原则?**
(1)如使用RFID,则须同时附带一维条码或二维码标签。
(2)标签不能仅有码图,需要同时附有中文标识说明。
(3)标签印刷质量符合ISO15415标准的C级以上。
(4)UDI编码与码图扫码内容须一致、正确。
(5)同时符合 AIDC(机器识读)与 HRI(人工识读)原则。
**(四)UDI标签/条码的张贴要求(UDI码在外箱/外包装上应该放到什么位置?)**
医疗器械唯一标识数据载体应当满足自动识别和数据采集技术以及人工识读的要求。如空间有限或者使用受限,应当优先采用符合自动识别和数据采集技术的载体形式。
自动识别和数据采集技术包括一维码、二维码或者射频标签等形式,数据载体应当位于标签、外包装或医疗器械本体上。
目前UDI载体应考虑如下问题:
1.应将UDI载体(UID的AIDC 和HRI标示)放置在标签上或器械本体上以及所有更高级别的器械包装上。更高级别的包装不包括运输容器。
2.若使用单元包装的器械上有明显的空间限制,UDI 载体可放置在更高级别的包装上。
3.对于一次性使用的,I 和IIa 类器械的独立包装,可不要求UDI 载体出现在包装上,但应出现在更高级别的包装上,如包含几个单独包装器械的纸箱。但当医疗保健提供者不能获得(家庭保健用途)更高级别的器械包装,UDI 应放置在独立器械的包装上。
4.对于专供零售网点(POS)销售的器械,AIDC 中的UDI-PI 可不需要出现在销售点包装上。
5.若存在限制条件时,不能同时使用AIDC和HRI时,要求只放AIDC;家庭护理产品,优先放HRI。
6.可重复使用的器械本体上应带有UDI载体。需要在患者使用之间进行消毒、灭菌或重新清理的可重复使用器械的UDI 载体在每次进行处理以使器械准备好在器械的整个预期使用寿命内进行后续使用之后应是永久的和可读的。本节的规定不适用于满足以下任一条件的任何器械:
(a) 任何类型的直接标记将对器械的安全或性能造成干扰;
(b) 该器械不能直接标记,因为其在技术上并非切实可行。
7.UDI 载体在器械正常使用和预期使用寿命内应是可读的。
8.若UDI 载体容易通过器械的包装或在AIDC 可扫描的情况下读取,则无需将UDI 载体放置在包装上。
9.若由多个部件组成且在首次使用前必须完成装配的单独成品器械,则其UDI 载体仅需放置在器械的一个部分上。
10.UDI 载体的位置应合理,以使在正常操作或储存期间可进行AIDC。
11.包括“UDI-DI”和“UDI-PI”的条形码载体还可包含器械操作的基本数据或其他数据。
**(五)发码机构在落实UDI中担任了什么角色?主要负责什么工作?**
医疗器械唯一标识的发码机构为中国境内的法人机构,具备完善的管理制度和运行体系,确保按照其标准创建的医疗器械唯一标识的唯一性,并符合我国数据安全有关要求。
发码机构应当向注册人/备案人提供执行其标准的流程并指导实施,为便于注册人/备案人等掌握发码机构的编码标准,供相关方选择或应用,发码机构应当将其编码标准上传至医疗器械唯一标识数据库并动态维护。每年1月31日前,发码机构应当向国家药品监督管理局提交按照其标准创建的唯一标识上一年度的报告。
**中广汇智·UDI公共平台**是由国家药监局指定发码机构中关村工信二维码技术研究院(ZIIOT)授权,湖南中广汇智自主研发的一站式UDI申报平台。既是发码机构也是服务平台,可为全国企业提供医疗器械UDI实施一站式服务。
平台以中关村MA码为核心,兼容GS1等多种码制,直接向企业发放合规UDI编码,可直接对接药监局数据库、企业ERP和产线设备,提供基于UDI发码、编码、申报、核验、赋码等一系列全流程服务。

扫码关注公众号,获取更多行业信息!

UDI资料免费获取
UDI实施报告及UDI政策汇编
 免费获取
免费获取
×


